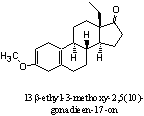Het Anabolenboek
Willem Koert
Aede de Groot
Wageningen, 29/2/2008
19. Steroïden in Designersupplementen
Aede de Groot, Willem Koert
We hebben in de vorige hoofdstukken aandacht geschonken aan natuurlijke anabolen, synthetische anabolen, prohormonen, hormoonderivaten en designersteroïden. In dit hoofdstuk behandelen we anabole steroïden in voedingsupplementen. Designer-supplementen, heten die met steroïden opgevoerde supplementen.
Steroïden in designersupplementen zijn niet "designed" om dopingjagers voor de gek te houden, maar om wettelijke beperkingen of patenten te omzeilen. Naar analogie van de definitie voor designersteroïden kunnen we designersupplementen definiëren als voedingsupplementen waarin anabole steroïden zitten die niet wettelijk verboden zijn. Meestal is de activiteit van die steroïden nooit getest op mensen. De meeste kennis over de anabole en andere effecten en eventuele bijwerkingen komt uit dierproeven en uit ervaringen van gebruikers.
In 2006 en 2007 hebben we via het internet designersupplementen verzameld en geprobeerd te achterhalen welke steroïden zich in die producten bevinden. Dat was niet altijd eenvoudig. De gebruikte naamgeving is vaak ouderwets, slordig en bewust onduidelijk. De lijst is niet volledig. Er verschijnen voortdurend nieuwe producten op de markt, soms met oude, soms met nieuwe steroïden. De lijst geeft echter wel een goede indruk van de manier waarop makers van designersupplementen hun producten samenstellen.
We hebben 75 verschillende steroïden gevonden, die we hier in groepen presenteren. We hebben de groepen samengesteld op basis van hun chemische structuur en hun werking. We hebben de prohormonen en hormoonderivaten van testosteron en dihydrotestosteron in de eerste twee groepen geplaatst. Omdat van veel van die steroïden ook 19-nor- en 17a-methyl-analogen voorkomen, hebben we die analogen in diezelfde groepen ondergebracht.
Daarna is de beurt aan steroïden met één of meerdere dubbele bindingen en met extra hydroxyl- of carbonylgroepen in het molecuul. Ook daar hebben we de 19-nor- en de methyl-analogen steeds in dezelfde groep meegenomen.
Tenslotte zijn er nog een kleine groep steroïden met een chloor- of broom-atoom in het molecuul en een grotere restgroep steroïden die we niet zo makkelijk in één van de andere groepen konden plaatsen.
Deze benadering maakt een onderverdeling mogelijk in negen groepen:
1) Prohormonen van testosteron en derivaten daarvan. Deze testosteron-achtige steroïden zijn geoxideerd of gereduceerd op C3 of C17. We hebben de 19-nor- en de 17a-methyl-analoga van deze steroïden ook in deze groep geplaatst.
2) Prohormonen van dihydrotestosteron en analoga daarvan. Deze steroïden hebben een 5aH-atoom en zijn geoxideerd of gereduceerd op C3 of C17. De overeenkomstige 2a- en 17a-methyl-analoga van
deze steroïden hebben we ook in deze groep geplaatst.
3) D1-testosteronverbindingen en derivaten daarvan. Deze steroïden zijn geoxideerd of gereduceerd op C3 of C17. We hebben de overeenkomstige 17a-methyl-analoga ook in deze groep geplaatst.
4) Steroïden met meerdere dubbele bindingen en derivaten daarvan. Deze steroïden zijn geoxideerd of gereduceerd op C3 of C17. We hebben de 19-nor- en de 17a-methyl-analoga van deze steroïden ook in deze groep geplaatst.
5) Steroïden met een extra hydroxyl- of carbonylgroep op C4 en derivaten daarvan. We hebben steroïden die geoxideerd of gereduceerd zijn op C3 of C17 en de 19-nor- en 17a-methyl-analoga ook in deze groep geplaatst.
6) Steroïden met een extra hydroxyl- of carbonylgroep op C6 en derivaten daarvan. Deze steroïden hebben allemaal een C17-carbonylgroep. We hebben steroïden met extra dubbele bindingen ook in deze groep geplaatst.
7) Steroïden met een extra hydroxyl- of carbonylgroep op C7 en derivaten daarvan. We hebben steroïden die zijn geoxideerd op C17 en een 17a-methyl-analoog ook in deze groep geplaatst.
8) Steroïden met chloor of broom.
9) Overige steroïden.
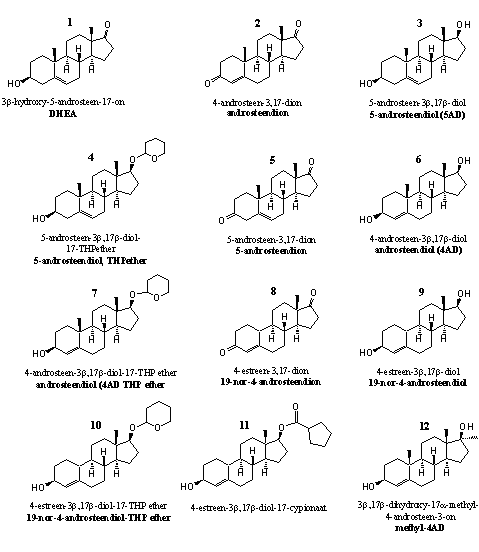
Groep 1. Prohormonen van testosteron en derivaten daarvan
Deze testosteron-achtige steroïden zijn geoxideerd of gereduceerd op C3 of C17. We hebben de 19-nor- en de 17a-methyl-analoga van deze steroïden ook in deze groep geplaatst.
Figuur 1
De steroïden 1, 2 en 3 op de bovenste rij zijn tussenproducten in de biosynthese van testosteron (zie Hoofdstuk 11). Het zijn prohormonen van testosteron. De bijnierschors geeft grote hoeveelheden DHEA en DHEA-sulfaat af. In weefsels zoals spieren, huid en prostaat zetten enzymen DHEA om in testosteron en dihydrotestosteron. [1] [2]
De meeste prohormonen van testosteron staan op lijst van verboden steroïden van de Amerikaanse Anabolic Steroid Control Act van 2004. DHEA niet, hoewel onderzoekers hebben vastgesteld dat DHEA een anabool steroid is, met een werking die niet wezenlijk anders is dan die van dihydrotestosteron en THG. [2] De beide andere prohormonen androsteendion 2 en 5-androsteendiol 3 staan wel op de lijst van de Anabolic Steroid Control Act. De dopinglijst van de mondiale dopingautoriteit WADA vermeldt DHEA overigens weer wel.
Gebruikers van supplementen zien DHEA in de eerste plaats als een anti-aging-middel, niet als een anabool steroid. De industrie heeft androsteendion en 5-androsteendiol als anabool gelanceerd, maar de ervaringen van de meeste gebruikers waren teleurstellend. Beide prohormonen bleken in de praktijk pas een anabole werking te hebben bij buitengewoon hoge doseringen, waarbij serieuze bijwerkingen optraden. Vooral de conversie naar estradiol zorgde voor problemen.
Verbinding 4 is prohormoon en derivaat tegelijk. In het lichaam moeten enzymen de THP-ether verwijderen en zo 5-androsteendiol 3 vormen. Het metabolisme kan dit daarna omzetten in testosteron.
Steroid 5 is ook een tussenproduct in de biosynthese van testosteron. Het enzym 3b-hydroxy-steroid dehydrogenase/D5-D4-isomerase, of 3b-HSD, oxideert eerst de hydroxylgroep aan C3 in DHEA 1 tot een carbonylgroep. Hetzelfde enzym katalyseert daarna ook de verschuiving van de dubbele binding van plaats 5 naar plaats 4 onder vorming van androsteendion 2. Testosteron ontstaat tenslotte als het enzym 17b-dehydrogenase in dion 5 de carbonylgroep op C17 reduceert tot een hydroxylgroep.
Steroid 6 rechts op de tweede rij is wel een prohormoon voor testosteron maar geen tussenproduct in de biosynthese. [3] [4] Hiervoor is al opgemerkt dat eerst de oxidatie van de C3-hydroxylgroep plaatsvindt en daarna pas de verschuiving van de dubbele binding. In verbinding 6 zit de dubbele binding al op de 4-plaats. Een 3b-dehydrogenase moet alleen nog de hydroxylgroep op C3 oxideren tot een carbonylgroep. De omzettingen verlopen hier dus eigenlijk in de omgekeerde volgorde. Verbinding 7 is het THP-etherderivaat van 6.
De steroïden 8-11 zijn prohormonen van nandrolon. Als in steroid 8 een 17b-dehydrogenase de carbonylgroep op C17 reduceert tot een hydroxylgroep ontstaat nandrolon. Onderzoekers vinden bij gebruikers van 8 dezelfde metabole uitscheidingsproducten als die van nandrolon zelf. [5] Dat bewijst dat de omzetting in nandrolon ook inderdaad optreedt.
In steroid 9 moet een 3b-dehydrogenase de hydroxylgroep op C3 oxideren tot een carbonylgroep. Onderzoekers hebben de effecten van bescheiden doseringen norandrosteendion 8 en norandrosteendiol 9 op getrainde atleten niet kunnen aantonen. [6]
Een voordeel van 19-nor-steroïden is dat hun 5a-gereduceerde producten minder sterk binden aan de androgeenreceptor dan dihydrotestosteron. Veel 19-nor-steroïden hebben daardoor minder androgene neveneffecten. Ze zijn milder voor de prostaat en hebben SARM-achtige eigenschappen. Recent hebben onderzoekers dergelijke SARM-achtige kwaliteiten aangetoond voor 19-nor-4-androstene-3b,17b-diol 9. [7]
Steroïden 10 en 11 zijn respectievelijk een THP-ether en een esterderivaat van 9.
Steroid 12 op de onderste rij is de 17a-methyl-analoog van 6. Russische onderzoekers hebben enkele dierstudies gepubliceerd waarin sprake is van anabole effecten. Oxidatie van de C3-hydroxylgroep geeft het anabole steroid 17a-methyltestosteron. Steroid 12 is een prohormoon daarvan. Gebruikers van anabole steroiden zijn overigens doorgaans weinig te spreken over 17a-methyltestosteron. De verbinding zou door aromatisering makkelijk leiden tot oestrogene nevenwerkingen. Bovendien kunnen anabole steroiden met een methylgroep op C17 verhoudingsgewijs makkelijk leverschade veroorzaken.
|
Aanvulling: PheraPlex Niet in het bovenstaande overzicht maar wel als designersteroid op de markt is de actieve stof in supplementen als PheraPlex en Ergomax LMG. Wetenschappers noemen hem madol, desoxymethyltestosteron of 17a-methyl-5a-androst-2-een-17b-ol. Voordat supplementenfabrikanten madol op de markt brachten experimenteerden chemische sporters ermee omdat dopingtests het middel niet konden opsporen. Ze kochten het van rogue chemists die het steroid waren tegengekomen in oude literatuur. We hebben over madol geschreven in Hoofdstuk 18.
|
|
Aanvulling: 4AD keert terug In 2004 verbood de Amerikaanse overheid een reeks prohormonen en steroïden in supplementen, waaronder prohormonen van testosteron. De Anabolic Steroids Control Act noemt echter geen prohormonen met een 17-one groep. Supplementenbedrijven hebben van die maas dankbaar gebruik gemaakt, en bijvoorbeeld 4-androstene-3b-ol-17-one als testosteronprecursor op de markt gezet.
|
|
Aanvulling: Decavol Net als de bovenstaande testosteron-analoog 4-androstene-3b-ol-17-one glipt deze nandrolon-analoog door de mazen van de Anabolic Steroids Control Act. Die wet noemt wel 4-estrene-3,17-dione 8 en 4-estrene-3b,17b-diol 9. Enzymen moeten aan die analogen respectievelijk een 17b-hydroxylgroep of een 3-oxogroep plakken wil nandrolon ontstaan. Het in 2008 als Decavol gelanceerde 4-estrene-3b-ol,17-one verandert pas in nandrolon als beide enzymatische transformaties hebben plaatsgevonden.
|
Groep 2. Prohormonen van dihydrotestosteron en analoga daarvan
Deze steroïden hebben een 5aH-atoom en zijn geoxideerd of gereduceerd op C3 of C17. We hebben de overeenkomstige 17a- en 2a-methylsteroïden ook in deze groep geplaatst.
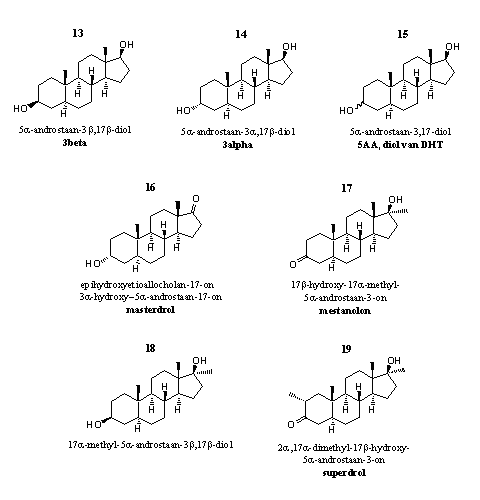
Figuur 2
In al deze steroïden zit geen dubbele binding op de 4-plaats. Dit betekent dat één van de essentiële structuurvoorwaarden voor aromatisering van ring A ontbreekt (zie Hoofdstuk 14). Je zult bij gebruik van deze steroïden dus niet snel last van gynecomastia krijgen.
Het is bij de steroïden in deze groep niet altijd duidelijk of ze bedoeld zijn als prohormoon of dat de steroïden zelf actief zijn. Handelaren adverteren ze wel als prohormoon.
Het doelhormoon kan in ieder geval niet testosteron of 17a-methyltestosteron zijn. Daarvoor zou er een dubbele binding op de 4-plaats moeten komen, en er zijn geen enzymen die deze reactie kunnen uitvoeren. In hoofdstuk 11 is al gezegd dat het enzym 5AR de dubbele binding uit testosteron kan weghalen en zo dihydrotestosteron kan vormen. Deze reactie is echter onomkeerbaar. Het her-invoeren van de dubbele binding is niet mogelijk.
De steroïden 13-15 zijn prohormonen voor dihydrotestosteron. 3b-Dehydrogenases zetten deze steroïden om in dihydrotestosteron. Je mag verwachten dat ze aanzienlijke androgene bijwerkingen hebben. De hydroxylgroepen in deze verbindingen kunnen echter gemakkelijk binden aan glucuronzuur of sulfaat. Als dat is gebeurd zullen de nieren de steroïden snel uitscheiden.
Steroid 13 zit in designersupplementen die mannelijke gebruikers een "alpha-gevoel" zouden moeten geven. De term "alpha-gevoel" is ontleend aan de ethologie. Een alphamannetje is het leidende dominante mannetje in een groep primaten. Saillant detail waarover je in de advertenties van de fabrikanten opvallend weinig leest: steroid 13 hecht in reageerbuisstudies aan de receptor voor estradiol.
Steroid 14 speelt een rol bij de verslavende werking van testosteron. In dierstudies is testosteron minder verslavend als onderzoekers met enzymblokkers de vorming van steroid 14 in de hersenen voorkomen. De verbinding heeft een euforiserende werking. Een recent overzichtsartikel heeft deze eigenschappen van steroid 14 nader toegelicht. [8]
Steroid 15 is de actieve stof in designersupplement 5AA. Het is een mengsel van de 3a- en de 3b-hydroxyverbindingen die je hierboven ziet als de steroïden 13 en 14. Deze mix van verbindingen moet de agressie verhogen waardoor gebruikers harder zouden kunnen trainen. Daarnaast claimt de fabrikant dat deze verbindingen door hun androgene eigenschappen vetlagen helpen reduceren.
We hebben veel moeite moeten doen om de structuur van steroid 16 te achterhalen, de actieve stof in het designersupplement Liquid Masterdrol. [9] De fabrikant noemt hem epihydroxyetioallocholan-17-on. Etioallocholan is een vooroorlogse naam voor een androstaanskelet (zie Hoofdstuk 5), epi betekent dat de hydroxylgroep anders zit. b-Hydroxy is normaal in die oude naamgeving. Hier hebben we dus te maken met een a-hydroxylverbinding. Het zou een prohormoon zijn dat uiteindelijk in het lichaam omgezet wordt in stanolon, aldus de fabrikant in zijn wervende teksten. Dat is niet onmogelijk. Stanolon is een ouderwetse naam voor dihydrotestosteron. Voor omzetting van 16 in dihydrotestosteron moeten dehydrogenases de carbonylgroep op C17 reduceren tot een b-hydroxylgroep, en moet die hydroxylgroep op C3 oxideren tot een carbonylgroep. Beide omzettingen zijn denkbaar.
Misschien dat steroid 14 een tussenproduct is in deze omzetting van steroid 16 en zorgt voor effecten als "increased focussing and intensity". Het prohormoon zou goed zijn voor spierdefinitie en kracht. We weten echter ook dat het eindhormoon dihydrotestosteron verantwoordelijk is voor androgene bijwerkingen.
Steroid 17 is het 17a-methyl-analogon van dihydrotestosteron. Het staat bekend onder de een tiental handelsnamen, waaronder mestalon, mestanolon en methylandrostanolon. Dit steroid is zelf een anabool steroid. [10-12] Het was in de communistische politiestaat DDR in gebruik als dopingmiddel, overigens zonder dat de DDR had onderzocht of mestalon wel veilig was.
Dopingjagers hebben steroid 18 veelvuldig gedetecteerd als een metaboliet van anabole steroïden. Steroid 18 is een metaboliet van 17, maar ook van methandrostenolon en 17a-methyltestosteron. Over de anabole activiteit is niet veel bekend. Het steroid is een prohormoon voor mestanolon 17, enzymen kunnen de hydroxylgroep op C3 oxideren tot een carbonylgroep en zo mestanolon vormen.
Steroid 19 is op de markt onder de naam superdrol. Sommige handelaren noemen het een prohormoon, maar dat is onjuist. Superdrol is gewoon zelf een actief anabool steroid. Superdrol lijkt op drostanolon (masteron). Het verschil tussen masteron en superdrol is dat drostanolon geen 17a-methylgroep aan de vijfring heeft, en superdrol wel. De krachtige anabole werking en de geringe androgene activiteit is door onderzoekers van Syntex al in 1959 vastgesteld. [14] De meest voor de hand liggende metabole omzetting is de reductie van de C3-carbonyl groep naar een a- en/of b-C3-hydroxylgroep. Zo’n omzetting vermindert meestal de anabole activiteit.
Gebruikers hebben superdrol leren kennen als een steroid dat schadelijk kan zijn voor de lever. Sinds superdrol als designersupplement op de markt is gekomen hebben artsen meer dan eens beschadiging van de lever en de nieren bij gebruikers moeten constateren. [14a]
|
Aanvulling: Viratase Niet in het bovenstaande overzicht maar wel als designersteroid op de markt geweest: de dione-analoog van dihydrotestosteron of 5a-androstan-3,17-one. Supplementenmaker Molecular Nutrition heeft het op de markt gebracht onder de naam Viratase. Molecular Nutrition had ook het Amerikaanse patent op het gebruik van deze stof als prohormoon voor dihydrotestosteron. [14b] Dat patent dekt ook het gebruik van steroid 13 en 14, maar niet dat van steroid 16, het mysterieuze bestanddeel van Liquid Masterdrol.
|
Groep 3. D1-Testosteronverbindingen en derivaten daarvan
Deze steroïden zijn geoxideerd of gereduceerd op C3 of C17. We hebben de overeenkomstige 17a-methyl-analoga ook in deze groep geplaatst.
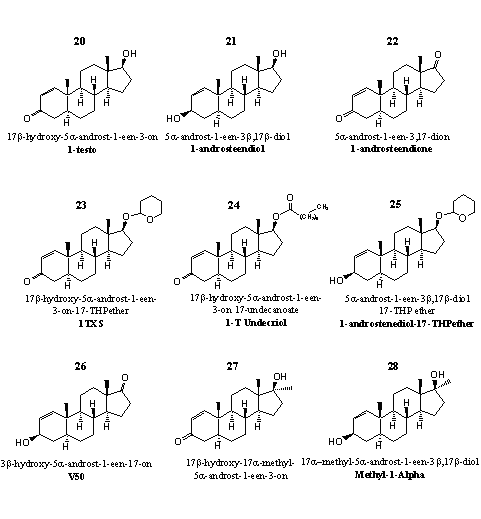
Figuur 3
In deze steroïden zit geen dubbele binding op de 4-plaats. Daardoor ontbreekt dus een essentiële structuurvoorwaarde voor aromatisering. Gynecomastia zal bij gebruik van deze steroïden geen bijwerking zijn.
1-Testosteron (1-Testo), steroid 20, is het centrale steroid in groep 3. Supplementenmakers prijzen 1-testosteron wel eens als prohormoon aan, maar dat is niet juist. Want in welke doelhormoon zou 1-testosteron moeten omzetten? De dubbele binding reduceren geeft dihydrotestosteron, en dat is niet anabool maar juist androgeen. Een extra dubbele binding aanbrengen op de 4-plaats geeft boldenon maar hierboven is al opgemerkt dat die reactie niet optreedt. Recent onderzoek heeft uitgewezen dat 1-testosteron zelf een potent anabool steroid is. Zijn anabole en androgene eigenschappen zijn vergelijkbaar zijn met die van testosteronpropionaat. [15] Er zijn opvallend veel preparaten met 1-testosteron in de handel geweest die gebruikers als gel op de huid moesten smeren.
Gebruikers omschrijven 1-testosteron als een krachtig anabool. De voornaamste bijwerkingen die ze op korte termijn ervaren zijn een lethargische stemming die soms lijkt op een depressie, en het verminderen van de eetlust. De gevolgen op de lange termijn zijn onduidelijk.
Voor 1-testosteron hebben bedrijven, net als voor testosteron, een reeks prohormonen en derivaten op de markt gebracht. De prohormonen 21 en 22 zijn gepatenteerd door Pat Arnold. [16] [17] In steroid 21 moet een 3b-dehydrogenase de hydroxylgroep op C3 oxideren tot een carbonylgroep. In steroid 22 moet een 17b-dehydrogenase de carbonylgroep op C17 reduceren tot een hydroxylgroep.
Steroïden 23 en 24 zijn respectievelijk de THP-ether en een esterderivaat van 1-testosteron. Steroid 25 is het THP-etherderivaat van 22 en dus tegelijkertijd een prohormoon en een derivaat van 1-testosteron.
Steroid 26 is ook bedoeld als een prohormoon voor 1-testosteron. Voordat 26 in 1-testosteron verandert moeten twee reacties plaatsvinden. Enzymen moeten de C3-hydroxylgroep oxideren tot een carbonylgroep en de C17-carbonylgroep reduceren tot een hydroxylgroep.
Steroid 27 is het 17a-methyl-analogon van 1-testosteron. Het is een krachtig anabool steroid. Chemici hebben het al in de jaren zestig van de vorige eeuw uitvoerig onderzocht. [18-20] Een patent van CIBA noemt dit steroid twintig maal actiever dan 17a-methyltestosteron en maar half zo androgeen. [21] Uit een eerder onderzoek kwamen bescheidener uitkomsten. Die studie rept van een anabole activiteit half zo groot als die van testosteronpropionaat. De androgene activiteit zou echter maar een kwart zijn van die van testosteronpropionaat. [20]
Nadat steroid 27 op de markt is gekomen hebben gezondheidsautoriteiten melding gemaakt van gebruikers die door designersupplementen met deze actieve stof leverschade opliepen.
De chemische structuur van de actieve stof in designersupplement Methyl-1-Alpha is omgeven met geheimzinnigheid. De leverancier noemt hem methyl-1-etiocholenolol. Het probleem van die verouderde naamgeving is dat chemici er niet uit kunnen afleiden waar de methylgroep en de dubbele binding zitten, en wat de oxidatiestaat precies is. We vermoeden echter dat het hier gaat om structuur 28. Onderzoekers van Searle hebben er al in 1962 over gepubliceerd. [20] Het anabool is net zo actief als de overeenkomstige C3-carbonylverbinding 27, maar de androgene activiteit is tweemaal zo hoog. Je kunt de steroïden 27 en 28 als prohormonen van elkaar beschouwen, maar ze hebben beide hun specifieke anabole en androgene activiteit.
Groep 4. Steroïden met meerdere dubbele bindingen en derivaten daarvan
Deze steroïden zijn geoxideerd of gereduceerd op C3 of C17. We hebben de 19-nor- en de 17a-methyl-analoga van deze steroïden ook in deze groep geplaatst.
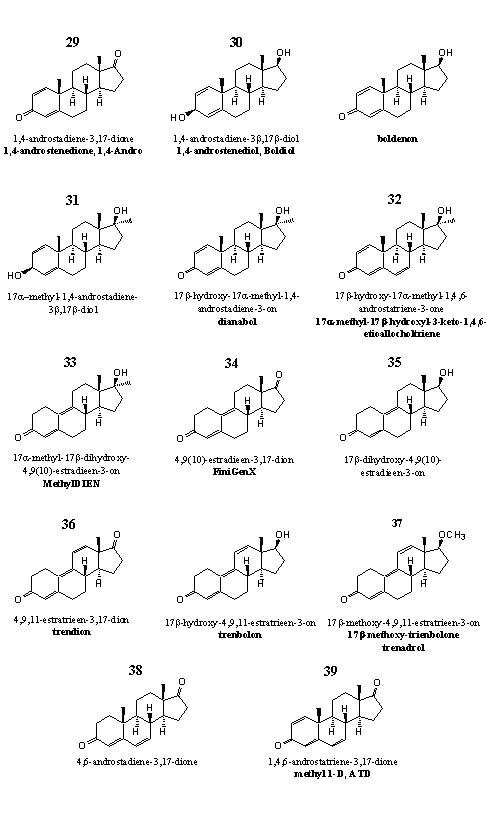
Figuur 4
De steroïden in groep 4 hebben overeenkomsten in hun chemische structuur, maar hun fysiologische activiteit loopt uiteen. Advertenties van handelaren merken vaak op dat hun nieuwe steroid veel lijkt op een andere verbinding maar nog beter werkt. Zulke opmerkingen kloppen meestal niet, zoals we hieronder zullen zien. Op elkaar lijkende steroïden hebben soms volkomen verschillende eigenschappen.
De steroïden 29 en 30 zijn prohormonen van het anabole steroid boldenon. We hebben de structuurformule er maar even bijgezet. In steroid 29 moet een 17b-dehydrogenase de carbonylgroep op C17 reduceren tot een hydroxylgroep, in steroid 30 moet een 3b-dehydrogenase de hydroxylgroep op C3 oxideren tot een carbonylgroep. 1,4-Androsteendion 29 is gepatenteerd als prohormoon. [22]
In 2007 brachten Amerikaanse supplementenbedrijven nog nieuwe preparaten met 29 als actieve stof op de markt. In het voorjaar van 2008 maakte DEA bekend dat het 29 als een volwaardig anabool steroid beschouwt dat niet vrij verkrijgbaar mag zijn.
Onderzoek heeft uitgewezen dat de metabolieten die proefpersonen uitscheiden na gebruik van quinbolon, de 17-cyclopentenyl-enolether van boldenon (zie Hoofdstuk 17), 1,4-androsteendion 30 en boldenon zelf, sterk op elkaar lijken. Dit wijst er op dat enzymen in het lichaam quinbolon en 1,4-androsteendion omzetten in boldenon. [23] Van steroid 30 (boldiol) hebben we geen gegevens over de biologische activiteit en omzettingspatroon kunnen vinden. We nemen echter aan dat enzymen de C3-hydroxylgroep in dit steroid snel oxideren en zo boldenon vormen.
Dat geldt ook voor steroid 31, het 17a-methyl-analogon van 30. Steroid 30 is bedoeld als prohormoon voor het welbekende anabool methandrostenolon, waarvan we de structuurformule eveneens in de bovenstaande figuur hebben opgenomen. Om te veranderen in methandrostenolon moet ook hier een 3b-dehydrogenase de hydroxylgroep op C3 oxideren tot een carbonylgroep. Verbinding 31 heeft dan wel een CAS-nummer, maar we hebben er nagenoeg niets over kunnen vinden. Zelfs publicaties over de synthese hebben we niet kunnen opsporen.
Over de biologische activiteit van steroid 32 is weinig bekend. [25] Het is een metaboliet van methandrostenolon die onderzoekers in de urine van methandrostenolongebruikers hebben gevonden. [26] Deze verbinding is echter ook een bijproduct in de bereiding van methandrostenolon uit methyltestosteron. De scheiding van het gewenste eindproduct methandrostenolon van het bijproduct 32 is moeizaam. [27] Analytisch-chemici die de uitscheidingsproducten van methandrostenolon analyseerden moeten daarom nagaan of de toegediende methandrostenolon zuiver is en geen steroid 32 bevat. Supplementenmakers stoppen steroid 32 ook in producten die de aanmaak van estradiol moeten remmen of die de natuurlijke afgifte van geslachtshormoon na hormoonkuren weer op gang moeten brengen.
Steroid 32 is misschien de actieve stof in het designersupplement Jungle Warfare. Volgens analyses door een erkend laboratorium bevat Jungle Warfare een keur aan steroïden in niet te verontachtzamen concentraties. [30] Eentje daarvan zou wel eens methandrostenolon kunnen zijn. [Deze passage is verouderd. Klik hier voor actuelere informatie.]
Steroid 33, de actieve stof in designersupplementen MethylDien en M-Dien, is al in 1960 gesynthetiseerd en getest door onderzoekers van Eli Lilly. [28] Volgens de onderzoekers heeft steroid 33 een uitzonderlijk hoge orale anti-oestrogene activiteit. Hetzelfde steroid is later ook onderzocht door het farmaceutische bedrijf Searle [29] Searle vond een androgene activiteit die vijf tot zeven hoger was dan die van 17a-methyltestosteron. De anabole activiteit was tachtig keer hoger dan die van 17a-methyltestosteron. Onderzoekers van Roussel-Uclaf hebben steroid 33 getypeerd als een hormoon met een verhoudingsgewijs hoge affiniteit met de progesteronreceptor. [27a] Aan die eigenschap, en aan zijn androgene werking, dankt steroid 33 wellicht zijn anti-oestrogene kwaliteit. Het steroid legt de endogene aanmaak van steroidhormonen stil. Daardoor vermindert ook de concentratie estradiol in het lichaam.
Van steroid 34 hebben we geen gegevens over biologische activiteit kunnen vinden. In de literatuur is het vooral beschreven als een bruikbaar tussenproduct in de synthese van andere steroïden. Een verkoper van een designersupplement met steroid 34 stelt in zijn advertentie: "Estra-4,9-diene-3,17-dione can easily be converted to trenbolone through organic chemical reactions." Dit kan inderdaad, maar alleen in een laboratorium. We denken niet dat die omzetting van estra-4,9-diene-3,17-dione in trenbolon in het lichaam kan optreden. De reductie van de C17-carbonylgroep tot een 17b-hydroxylgroep is goed mogelijk, maar de invoering van de derde dubbele binding tussen C11 en C12 is nooit waargenomen en onwaarschijnlijk.
Steroid 34 zal geen prohormoon voor trenbolon zijn zoals het bedrijf suggereert, hooguit voor een steroid met een dubbelbinding minder, 17b-hydroxy-4,9(10)-estradieen-3-on 35. Dit steroid is getest door dezelfde onderzoekers die ook 33 hebben gemaakt en getest. [29] Steroid 33 heeft een 17a-methylgroep en is actiever dan steroid 35, waar die methylgroep ontbreekt. De androgene en anabole activiteit van 35 is ongeveer gelijk aan die van 17a-methyltestosteron.
We citeren nog even de advertentie voor steroid 34. "Estra-4,9-diene-3,17-dione molecule is literally the closest thing to trenbolone on the market." Of dat klopt, laten we even in het midden, maar we hebben wel een tip voor de producenten van designersupplementen. Wat dacht u van trendion 36? Dat zit nog dichter bij trenbolon. Een 17b-dehydrogenase kan 36 daadwerkelijk omzetten in trenbolon.
De methylether van trenbolon 37 is op de markt gebracht als designersupplement onder namen als trenadrol en methoxytren. Na analyse van het supplement bleek echter dat er geen methoxygroep in de actieve stof aanwezig was. Het supplement bevatte gewoon trenbolon. [30]
Aromataseremmers
De steroïden 38 en 39 hebben overeenkomsten in chemische structuur met de andere verbindingen in groep 4, maar hun biologische activiteit is anders. Deze twee verbindingen zijn aromataseremmers. Zij vormen dus een complex met het enzym aromatase, en niet met een receptor. In Hoofdstuk 9 hebben we het verschil tussen een enzym en een receptor besproken.
Niet alleen de steroïden 38 en 39 zijn aromataseremmers. Ook een deel van de steroïden in de groepen 5 en 6 en het 6-broom-steroid 61 uit groep 8 remmen aromatase. Ze kunnen dat doen als competatieve remmer of als zelfmoordsubstraat.
Een competatieve remmer wedijvert met het natuurlijke substraat om complexering met het enzym. Als er meer van de remmer aanwezig is wint de remmer de strijd. Het natuurlijke substraat of een toegediend anabool steroid kan het enzym niet meer bereiken. Dat steroid reageert dan niet meer tot een aromaat. Als de hoeveelheid remmer lager is, kan het natuurlijke substraat of een toegediend anabool steroid nog in beperkte mate complexeren met het enzym en op de normale manier aromatiseren.
Een zelfmoordsubstraat bindt zo sterk aan het enzym dat het complex niet meer uit elkaar gaat. Het enzym is daardoor voorgoed geblokkeerd, nieuwe substraten kunnen er niet meer in.
Steroid 38 is een competatieve remmer; steroid 39, de steroïden 40 en 41 in groep 5, de steroïden 49 en 52 in groep 6 en het 6-broom-steroid 61 zijn zelfmoordsubstraten.
Aromataseremmers zijn nuttig voor chemische sporters die hoge doses gebruiken van anabolen die kunnen aromatiseren, en kans lopen op gynecomastia. De structuurvoorwaarden voor aromatisering zijn in Hoofdstuk 14 behandeld. Daar hebben we aangegeven welke veranderingen je in anabole steroïden kunt aanbrengen om aromatisering te voorkomen. Voorbeelden daarvan vind je ook in de groepen 2 en 3 van dit hoofdstuk. Er zijn echter ook anabole steroïden, steroidderivaten en prohormonen die wel kunnen aromatiseren, zoals testosteron en de prohormonen van groep 1, androsteendion voorop.
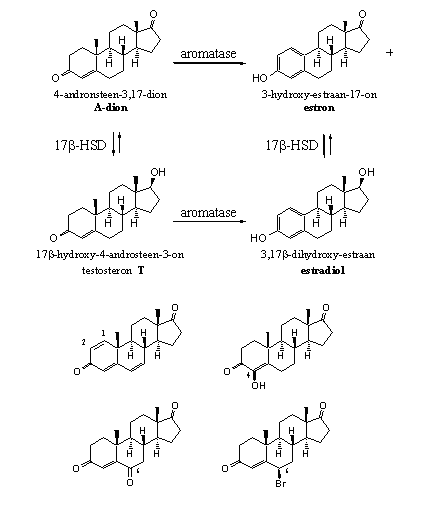
We kunnen vier structuurveranderingen aanbrengen in androsteendion om van dat natuurlijke substraat van aromatase een zelfmoordsubstraat te maken (zie Schema 1). [31] Dat zijn:
1) Het aanbrengen van een dubbele binding tussen C1 en C2. (Groep 4) Een voorbeeld is steroid 39 of ATD.
2) Het aanbrengen van een hydroxylgroep op C4. (Groep 5) Een voorbeeld is steroid 40 of Formestan.
3) Het aanbrengen van een carbonylgroep op C6. (Groep 6) Een voorbeeld is steroid 49 of 6-OXO.
4) Het aanbrengen van een broom-atoom op C6 (Groep 8) Een voorbeeld is steroid 61 of Hyperdrol.
Bovengenoemde substraten verlaten het enzym-substraat-complex niet meer omdat er een echte covalente chemische binding optreedt tussen substraat en enzym. Waarom dat bij deze substraten wel optreedt en bij de natuurlijke substraten niet, dat is nog steeds niet geheel duidelijk. Het illustreert wel weer de eerder gemaakte opmerking dat relatief kleine veranderingen in de structuur van een steroid grote gevolgen kunnen hebben voor hun biologische activiteit.
Schema 1
Gebruikers van designersupplementen kennen aromataseremmers vooral als middel voor hun post cycle therapy of PCT. Bedrijven adviseren deze middelen te gebruiken na een kuur met anabole steroïden om de endogene aanmaak van testosteron weer op niveau te brengen. Ze verlagen de estradiolspiegel, en prikkelen zo de hypothalamus en de hypofyse om via hormonen de testes tot activiteit aan te sporen. We laten in het midden in hoeverre het gebruik van androgene aromataseremmers voor PCT zin heeft, en of al de aromataseremmers die als supplement op de markt zijn daarvoor wel geschikt zijn.
Onderzoekers ontdekten al in 1973 dat steroid 38 een goede remmer van het enzym aromatase is. [32] Het is een competatieve remmer, waarvan de structuur-werkingsrelaties van gesubstitueerde derivaten zijn onderzocht. [33-35] Die structuurvarianten zijn niet op de markt verschenen, waarschijnlijk omdat betere remmers beschikbaar kwamen.
Steroid 39 is de bekende aromataseremmer ATD. Het is waarschijnlijk een zelfmoordsubstraat. [31] [36] Patenten claimen daarnaast nog meer biomedische effecten. [37] [38]
Groep 5. Steroïden met een extra hydroxylgroep op C4 en derivaten daarvan
We hebben steroïden die geoxideerd of gereduceerd zijn op C3 of C17 ook in deze groep geplaatst. Dat hebben we ook gedaan met de 19-nor- en 17a-methyl-analoga.
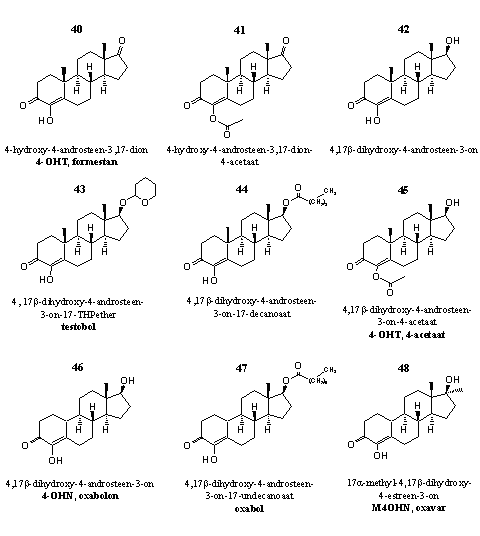
Figuur 5
Het basissteroid in deze groep is 4-hydroxy-3-androsteen-3,17-dion (Formestan) 40. Deze verbinding is ook te koop als een gel die gebruikers op hun huid moeten smeren. Formestan 40 en het overeenkomstige 4-acetaat 41 zijn krachtige aromataseremmers. [39] [40] Beide verbindingen zijn zelfmoordsubstraten. [31] [36]
De 17b-hydroxy analoog van 40, 4-hydroxytestosteron 42 is een zwakkere aromataseremmer [32] dan 40. Dopingexperts zijn 42 eerder als een anabool steroid. [41] Daarom vind je 42 als zodanig vermeld op de dopinglijst van de WADA. [42] Patenten van Amerikaanse producenten van designersupplementen claimen effecten zoals verlaging van het oestrogeenniveau bij oudere mannen [43] en een toename van het atletisch vermogen. [44]
De steroïden 43, 44 en 45 zijn respectievelijk de THP-ether, de decanoaat-ester en het 4-acetaat van 4-hydroxytestosteron.
De 19-nor-steroïden 46-48 op de onderste rij zijn geen goede aromataseremmers. Dat komt volgens een theorie omdat deze 19-nor-steroïden niet kunnen omzetten in een tussenproduct dat een cruciale rol in de aromatisering van androstanes speelt. Dat is het steroid waarin de C19-methylgroep al is geoxideerd tot een carbonylgroep (zie Hoofdstuk 14, Schema 2). Als in dit tussenproduct een 4-hydroxy, een D1,2-dubbele binding, een 6-ketogroep of een 6-broom atoom aanwezig zijn, dan vormt zich een sterk covalent aan het enzymgebonden product dat het enzym niet meer verlaat. In de 19-nor-steroïden zit echter geen C19- methylgroep en het aromatase kan dat betreffende tussenproduct dus ook niet vormen. [45]
Deze 19-nor-steroïden zijn al in het begin van de zestiger jaren van de vorige eeuw door een Italiaanse groep onderzocht en gepatenteerd. [46] De anabole eigenschappen zijn toen al gesignaleerd, maar daarna hebben onderzoekers er weinig aandacht meer aan besteed. Esters en ethers van deze steroïden zijn later door Amerikaanse makers van designersupplementen opnieuw gepatenteerd. [47]
Steroid 47 is een ester van 46, steroid 48 is het 17a-methyl-analogon van 46.
Groep 6. Steroïden met een extra hydroxyl- of carbonylgroep op C6
Deze steroïden hebben allemaal een C17-carbonylgroep. We hebben steroïden met extra dubbele bindingen ook in deze groep geplaatst.
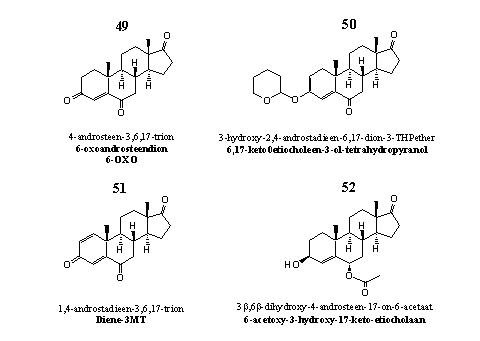
Figuur 6
Het steroid waar het in groep 5 om draait is 6-OXO of wel 4-androsteen-3,6,17-trion 49. Ook dit steroid is een zelfmoordsubstraat en dus ook een krachtige aromataseremmer. Ook voor 6-OXO is vastgesteld dat zijn C19-carbonyltussenproduct betrokken is bij het remmingsproces. [48] [49] In 2005 patenteerde Pat Arnold steroid 49 als een middel dat de lichaamseigen testosteronproductie stimuleert. [50]
De hypothalamus laat via het signaleringssysteem van Hypothalamus-Hypofyse-Testes (zie Hoofdstuk 20) de testes meer testosteron aanmaken naarmate er minder androgeen, oestrogeen en gestageen in het bloed circuleert. Een lage estradiolspiegel levert dus een prikkel voor de testes om meer testosteron aan te maken. Geef je mannen een anti-oestrogeen, dan stijgt hun testosteronspiegel. Dat gebeurt dus ook als je mannen 6-OXO geeft. De toegenomen aanmaak van testosteron leidt overigens ook weer tot een stijging van de estradiolspiegel, aldus een recente studie onder zestien bodybuilders. [51]
Steroidderivaat 50 is de THP-ether van de enolvorm van de C3-carbonyl-analoog van steroid 49. Beide structuurelementen, de THP-ether en de enolether, zijn niet stabiel in de zure omgeving van de maag. Daar zal dit steroid dan ook snel hydrolyseren tot 6-OXO 49. Steroid 50 zit samen met ATD in designersupplement Novedex XT. Door de fabrikant betaalde studies hebben de testosteronverhogende eigenschappen van Novedex XT bevestigd. [52]
Steroid 51 is te koop als aromataseremmer. We hebben er echter geen wetenschappelijke publicaties over kunnen vinden.
Ook steroid 52 kom je tegen in designersupplementen. In reclameteksten zegt de fabrikant dat het actieve ingrediënt 52 aromatase remt. We hebben hiervoor geen bevestiging kunnen vinden in de wetenschappelijk literatuur. De overeenkomstige C3-carbonylverbindingen zijn wel uitvoerig onderzocht op hun aromataseremmende werking. [53] De onderzoekers stellen echter vast dat de 6a-verbindingen actiever zijn dan de overeenkomstige 6b-derivaten.
Groep 7. Steroïden met een extra hydroxyl- of carbonylgroep op C7 en derivaten daarvan
We hebben steroïden die zijn geoxideerd op C17 en een 17a-methyl-analoog ook in deze groep geplaatst.
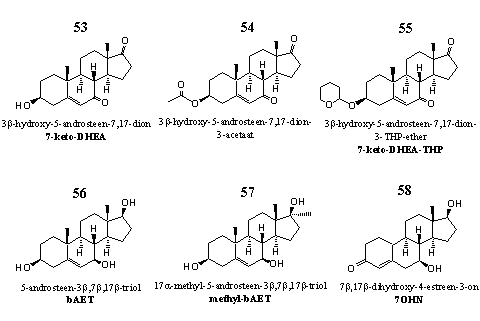
Figuur 7
De meeste steroïden uit groep 7 hebben een andere biologische activiteit dan de steroïden in de andere groepen. Ze stimuleren de vetverbranding. [54] Deze eigenschap heeft de aandacht getrokken van supplementenbedrijven, die preparaten hebben gepatenteerd met 7-keto-DHEA 53 als actief ingrediënt. [55-57] Steroid 54 is het acetaat, steroid 55 de THP-ether van 7-keto-DHEA.
Steroid 56 is een metaboliet van 7-keto-DHEA, maar we kunnen hem ook zien als een prohormoon daarvoor. Het steroid speelt een rol in het immuunsysteem van het lichaam. [58] De 17a-methyl-analoog 57 is gepatenteerd als een immunostimulant. [59]
Over steroid 58 hebben we geen wetenschappelijk literatuur kunnen vinden. We weten ook niet welk effect dit steroid zou moeten hebben. Steroid 58 sluit qua structuur niet aan bij één van de andere steroïden in dit hoofdstuk.
|
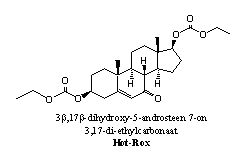
Aanvulling: Hot-Rox De actieve stof in Hot-Rox, een designersupplement uit de koker van Bio-Test, lijkt op de steroïden 56 en 53. Van beide steroïden is de verbinding zowel een derivaat als een prohormoon. Als esterases de carbonaatesters hydrolyseren en de carbonylgroep op C7 gereduceerd wordt, krijg je 56. Maar kunt er ook op een andere manier naar kijken, en de component zien als een prohormoon voor 7-keto-DHEA 53. Ook in dat geval moeten de esterases de carbonaatesters hydrolyseren. Als daarna de C17-hydroxylgroep oxideert tot een ketogroep, dan ontstaat 53.
|
Groep 8. Steroïden met chloor of broom
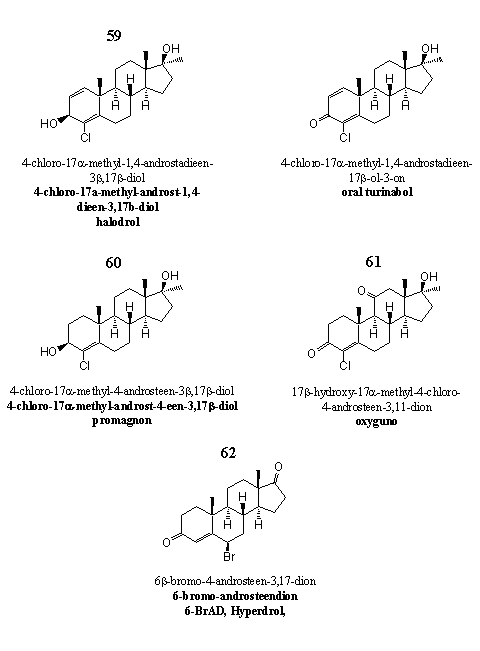
Figuur 8
De steroïden 59 en 60 zijn oude bekenden en toch ook weer niet. Dopinexperts kennen verbinding 59 met op de C3-plaats een carbonylgroep in plaats van een hydroxylgroep als Oral-Turinabol, een anabool steroid dat de vroegere DDR aan zijn sporters gaf.
Supplementenfabrikanten hebben steroid 59 op de markt gebracht onder de naam Halodrol. Het is een prohormoon voor Oral-Turinabol. Dehydrogenases kunnen de C3-hydroxylgroep gemakkelijk oxideren tot een carbonylgroep. Het metabolisme van Oral-Turinabol in de mens is onderzocht [60], maar we hebben nauwelijks wetenschappelijke literatuur over Halodrol kunnen vinden.
Je zou steroid 60 kunnen zien als een prohormoon voor 17a-methyl-clostebol. [61] Enzymen moeten dan de C3-hydroxylgroep oxideren tot een carbonylgroep. Advertenties beweren dat de 17a-methyl-analoog meer anabole activiteit heeft dan het originele molecuul. Daarover hebben we in de literatuur echter niets kunnen terugvinden. Evenmin hebben we studies gevonden die vertellen in hoeverre steroid 60 veilig is voor de lever.
Steroid 61 is in 2007 op de markt verschenen als Oxyguno. Analyses hebben uitgewezen dat designersupplementen met 61 eigenlijk twee actieve stoffen bevatten: de 11-oxo- en een 11b-hydroxy-analoog. Volgens dierstudies uit de jaren zestig heeft de 11-oxo-analoog 61 zeven procent van de androgene werking van testosteron, maar is zijn anabole werking 850 procent groter dan die van testosteron. De 11b-hydroxy-analoog van het steroid is door de DDR in het diepste geheim gebruikt als anabool steroid voor sporters. Documenten uit de archieven van Oost-Duitse geheime dienst noemen het anabool Substanz XII.
Het broombevattende steroid 62, 6-broom-androsteendion, is onder meer op de markt onder de naam Hyperdrol. Het niet duidelijk of in die producten een 6a- of een 6b-broomsteroid zit. Beide steroïden zijn aromataseremmers. [62]
Groep 9. Overige steroïden
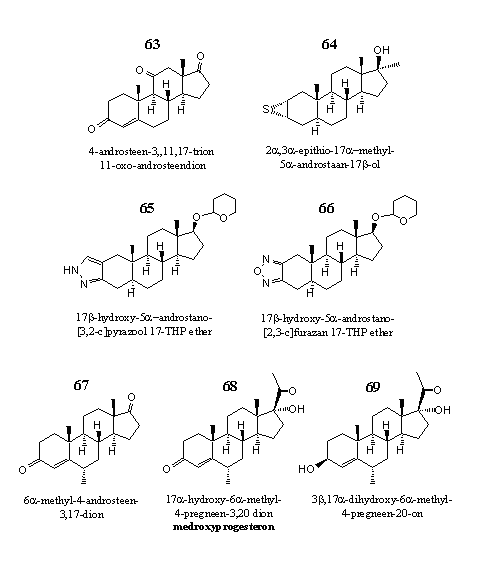
Figuur 9
In deze laatste groep hebben we zeven steroïden bij elkaar gezet die in geen van de andere groepen thuishoren. Steroid 63 is een 11-oxo steroid, dat bedrijven overigens ook onder de naam 11-OXO verkopen. De makers van 11-OXO claimen niet dat 11-oxo-androstenedione een anabole werking heeft, maar dat het de vorming van het katabole hormoon cortisol in het lichaam vermindert. Het remt het enzym 11b-hydroxysteroid-dehydrogenase type 1, dat het weinig actieve stresshormoon cortison omzet in cortisol. Een ander designersupplement dat 11-oxo-androstenedione bevat is 3-AD.
Steroid 64 heeft een karakteristieke, maar in steroïden zelden voorkomende thioepoxide aan ring A. Het is op de markt als Havoc en Hemaguno. Steroid 64 is de C17amethyl-analoog van een androgeen dat Japanse farmaceuten hebben ontwikkeld als medicijn tegen borstkanker.
De steroïden 65 en 66 zijn THP-ethers van steroïden met een heterocyclische aromaat aan ring A. Steroid 65 is op de markt als Prostanozol en Orastan-E. Dopingjagers hebben het wel eens aangetroffen in de urine van gewichtheffers en marathonlopers. Steroid 65 lijkt op de klassieke anabole steroïde stanozolol, maar verschilt daarvan doordat de methylgroep op C17 is weggelaten en de hydroxygroep is vervangen door een THP-ether. Waarschijnlijk valt die groep in het zure milieu van de maag al van het steroid af.
Steroid 66 is de actieve stof in designersupplementen als Furazadrol en Furaguno. Het is ontwikkeld in de jaren zestig door het Japanse Daiichi. Net zoals steroid 65 lijkt op stanozolol lijkt 66 op furazabol, een Japans stanozolol-achtig anabool.
De steroïden 67, 68 en 69 hebben alle drie een 6a-methyl groep. De laatste twee zijn progesteron-analoga. Steroid 67 is een remmer van het enzym aromatase. Het is afgaande op de etikettering van de fabrikant een bestanddeel van designersupplement Methyl 1-P, samen met steroid 68. Steroid 69 is, alweer volgens gegevens van de fabrikant, een bestanddeel van maaltijdvervangers en sportdrankjes.
|
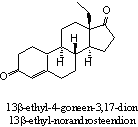
Aanvulling: X-Mass
Het steroid op de figuur hiernaast is 13b-ethyl-3-methoxy-2,5(10)-
Hij doet doet ergens aan het designersteroid Norboleton denken...
|
Conclusie
Al de steroïden die we in dit hoofdstuk hebben genoemd zitten in preparaten die de fabrikanten of verkopers voedingssupplementen noemen. Ze liggen in supplementenwinkels te koop, op het internet maar ook in winkels die je fysiek kunt binnenlopen. De webwinkels vermijden in hun advertenties voor deze voedingssupplementen vaak zorgvuldig de term "anabool steroid" en gebruiken meer verhullende termen. De aanduiding "prohormoon" is populair.
Veel van de steroïden in voedingsupplementen zijn overigens ook prohormonen. Je kunt je echter wel afvragen wat nu eigenlijk het verschil is tussen een prohormoon en een echt anabool, als enzymen het prohormoon in het echte anabool omzetten. Een aantal steroïden in voedingsupplementen zijn gewoon zelf al "full blown" anabole steroïden.
Fabrikanten en winkels verkopen deze designersupplementen op een andere manier dan handelaren en web-apotheken de "echte" anabole steroïden verkopen. De producten waarover dit hoofdstuk gaat liggen in andere webwinkels, ze hebben een andere uitstraling en zijn ontworpen voor een andere doelgroep. We behandelen hierboven 75 steroïden, maar het aantal supplementen waar die in zitten is veel groter. Jaren geleden schatte het Amerikaanse ConsumerLabs.com, een bedrijf dat voedingssupplementen analyseert, het aantal hormoonachtige supplementen op meer dan achttienduizend. [63]
De wettelijke status van deze designersupplementen is complex. De Nederlandse en Belgische wetgevers beschouwen ze als medicijnen en verbieden hun vrije verkoop. Desondanks circuleren designersupplementen ook hier. Gebruikers kopen ze op internet, en sommige supplementen met bovenstaande steroïden liggen in Nederlandse en Belgische winkels.
De Amerikaanse wet verbiedt sommige van deze producten, maar andere ook weer niet. Sportorganisaties beschouwen ze als doping, maar niet alle steroïden die we hierboven noemen staan op hun lijsten. Bovendien vermoeden we dat dopingjagers niet alle vermelde verbindingen kunnen opsporen.
We benadrukken nogmaals dat hier sprake is van voedingsupplementen met farmacologische doseringen. We hebben het niet over de hormonale verontreinigingen in supplementen, die sporters een positieve dopingtest bezorgen. Die verontreinigingen hebben waarschijnlijk geen effect op de prestaties of de gezondheid. Deze voedingsupplementen hebben dat wel.
De in dit hoofdstuk geschetste situatie geeft aanleiding tot zorg. Er is een categorie voedingsupplementen op de markt die verboden en potentieel gevaarlijke steroïden bevat. Die steroïden zijn meestal niet getest op mensen. Over hun bijwerkingen is dus weinig bekend. Deze producten worden bovendien op zo’n manier gepresenteerd dat consumenten niet altijd zullen of kunnen weten wat ze eigenlijk gebruiken. Daar komt nog bij dat het niet altijd zeker is dat de stof die het etiket vermeldt ook werkelijk in het preparaat zit. [64]
Weet waar je aan begint.
[1] Labrie F.; Luu-The V.; Belanger A.; Lin S.-X en Labrie C. J. Endocrinologie (2005) 187, 169-196.
[2] Labrie F.; Luu-The V.; Martel C.; Chernomoretz A. Calvo E.; Morissette J. en Labrie C. J. of Steroid
Biochemistry and Molecular Biology (2006) 100, 52-58.
[3] Earnest C.P.; Olson M.A.; Broeder C.E.; Breuel K.F.; en Beckham S.F. European Journal of Applied Physiology
(2000) 81, 229-232.
[4] Arnold P. US patent 5880117.
[5] Uralets V.A. en Gilette P.A. Journal of Analytical Toxicology (1999) 25, 357-366.
[6] Van Gammerden D.; Falk D. en Antonio J. Nutrition (2002) 18, 734-737.
[7] Page S.T.; Marck B.T.; Tolliver J.M. en Matsumoto A.M. Endocrinology. 2007 Dec 20 [Epub ahead of print].
[8] Frye C.A. Pharmacology, Biochemistry and Behavior (2007) 86, 354-367.
[9] Ergogenics, 10/12/2006.
[10] Schänzer W. en Donike M. Analytica Chemica Acta (1993) 275, 23-48.
[11] Nutting E.F.; Klimstra P.D. en Counsel R.E. Endocrinologica (1966) 53, 635-643.
[12] Nutting E.F.; Klimstra P.D. en Counsel R.E. Endocrinologica (1966) 53, 627-634.
[13] Abell L.L. en Mosbach E.H. Journal of Lipid Research (1968) 9, 98-102.
[14] Ringold H.J.; Batres E.; Halpern O. en Necoechea E (Syntex) Journal of the American Chemical Society
(1959) 81, 427-432.
[14a] Shah N.L.; Zacharias I.; Khettry U.; Afdhal N. en Gordon F.D. Clin Gastroenterol Hepatol. 2008 Feb;6(2):255-8; Jasiurkowski B.; Raj J.; Wisinger D.; Carlson R.; Zou L.; en Nadir A. Am J Gastroenterol. 2006 Nov;101(11):2659-62; Kafrouni M.I.; Anders R.A. en Verma S. Clin Gastroenterol Hepatol. 2007 Jul;5(7):809-12.
[14b] Llewellyn W.C. US patent 6242436.
[15] Friedel A.; Geyer H.; Kamber M.; Laudenbach-Lechowsky U.; Schänzer W.; Thevis M.; Vollmer G.; Zierau O. en Diel P.
Toxicology Letters (2006) 165, 149-155.
[16] Arnold P. US patent 2001056087.
[17] Arnold P. US patent 2001041698.
[18] Neumann F.; Wiechert R. (Schering-Berlin) Arzneimittel-Forschung (1965) 15, 1168-1184.
[19] Pelc B. Tsjechisch patent nr CS 110079.
[20] Counsel R.E.; Klimstra P.D. en Cotton F.B. (Searle) Journal of Organic Chemistry (1962) 27, 248-253.
[21] CIBA Belgisch patent BE 638956.
[22] Llewellyn W.C. Us patent 2003027805.
[23] Galletti F. en Gardi R. Steroids (1971) 18, 39-50.
[24] Foell T.J.; Rees R.W.; Bright R.E. en Smith H. Wyeth labs. Chemistry and Industry (1967) 34, 1452-1453.
[25] Ergogenics 15/4/2006.
[26] Duerbeck H.W.; en Bueker I. Biomedical Mass Spectrometry (1980) 7, 437-445.
[27] Lala A.K. en Kulkarni A.B. Steroids (1973) 22, 763-766.
[27a] Ojasoo T.; Delettre J.; Mornon JP.; Turpin-VanDycke C. en Raynaud J.P.; J Steroid Biochem. (1987) 27, 255-269.
[28] Perelman M.; Farkas B.; Fornefeld E.J.; Kraay R.J. en Rapala R.T. Journal of the American Chemical Society
(1960) 82, 2402-2403.
[29] Nutting E.F. en Calhoun D.W. Searle Endocrinology (1969) 84, 441-442.
[30] Koert W. en De Groot Ae. Sport en Fitness (2007) 25, 141 68-70;
Ergogenics 19/8/2007.
[31] Covey D.F. en Hood W.F. Cancer Research (1982) 42, 3327-3333.
[32] Schwarzel W.C.; Kruggel W.C. en Brodie H.J. Endocrinology (1973) 92, 666-680.
[33] Numazawa M. en Yoshimura A. Journal of steroid biochemistry and Molecular Biology (1999) 70, 189-196.
[34] Numazawa M.; Oshibe M. en Yamaguchi S. Steroids (1997) 62, 595-602.
[35] Breuggemeier R.W.; Li P.K.; Chen H.H.; Moh P.P. en Katlic N.E. Journal of Steroid Biochemistry and Molecular
Biology (1990) 37, 379-385.
[36] Brodie A.M. Cancer Research (1982) 42, 3312-3314.
[37] Kneller B.W. US patent 2006154909.
[38] Elbrecht A.; Yang Y.T. en Smith R.G. European patent 497570.
[39] Marsh D.A.; Brodie H.J.; Garrett W.; Tsai-Morris C,H, en Brodie A.M.H. Journal of Medical Chemistry
(1985) 28, 788-795.
[40] Rowlands M.G.; Foster A.B.; Mann J.; Pietrzak B.; Wilkinson J. en Coombes Steroids (1987) 49, 371-382.
[41] Sala G. Hormonal Steroids (1964) 1, 67-75.
[42] Kohler M.; Parr M.K.; Opfermann G.; Thevis M.; Schlörer N.; Marner F-J. en Schänzer W. Steroids (2007)
72 278-286.
[43] Llewellyn W.C. US patent 2003229063.
[44] Abraham S. US patent 2003199487.
[45] Covey D.F. en Hood W.F. Molecular Pharmacology (1982) 21, 173-180.
[46] Camerino B.; Patelli B. en Seiaky R. It patent 19610210, US patent 3068247.
[47] Abraham S. US patent 2003199466, US patent 2004002483.
[48] Numazawa M.; Mutsumi A. en Tachibana M. Biochemical Pharmacology (1996) 52, 1253-1259.
[49] Numazawa M. Sugiyama T. en Nagaoka M. Biological and Pharmaceutical Bulletin (1998) 21, 289-292.
[50] Arnold P. Us patent 2005059646.
[51] Rohle D.; Wilborn C.; Taylor L.; Mulligan C.; Kreider R. en Willoughby D.
J Int Soc Sports Nutr. 2007 Oct 19;4:13.
[52] Willoughby D.S.; Wilborn C.; Taylor L. en Campbell W. Int J Sport Nutr Exerc Metab. 2007 Feb;17(1):92-108.
[53] Numazawa M.; Shelangouski M. en Nagasaka M. Steroids (2000) 65, 871-882.
[54] Lardy H.; Marwah A. en Marwah P. Vitamins and Hormones (2005) 71, 263-299.
[55] Romero T. US patent 2006233828.
[56] Zweifel J. US patent.
[57] Zenk J.L. US patent 2004062606.
[58] Loria R.M.; Padgett D.A. en Huyth P.N. Journal of Endocrinology (1996) 150.
[59] Christensen B.G. en Webb T.R. WO 9610527.
[60] Schumann W. Die Pharmacie (1991) 46, 850-654.
[61] Ergogenics 20/4/2006.
[62] Ergogenics 3/4/2006.
[63] New York Daily News 25/12/2005.
[64] Musshof F.;Daldrup T. en Ritsch M. Journal of Forensic Sciences (1997) 42, 1119-1125.
|
|