Het Anabolenboek
Willem Koert
Aede de Groot
Wageningen, 29/11/2006
7. Het Ligand-Androgeenreceptor Complex
Aede de Groot, Willem Koert
In de vorige hoofdstukken hebben we gezien hoe koolstofverbindingen zijn opgebouwd uit atomen, en hoe die atomen samen een molecuul vormen. Voor het steroidhormoon testosteron hebben we de vorm van het molecuul verder uitgewerkt in hoofdstuk 4.
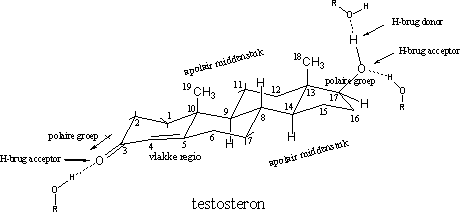
De ruimtelijke structuurformule van testosteron geeft aan dat testosteron een betrekkelijk vlak skelet heeft, dat bestaat uit drie zesringen en een vijfring. Aan dit steroidskelet zitten een aantal substituenten, aan C3 een carbonylgroep, aan C17 een hydroxylgroep en aan C10 en C13 een methylgroep (respectievelijk C19 en C18). Er zit een dubbele binding tussen C4 en C5, waardoor het molecuul vlak is in die omgeving. De atomen C3, C4, C5, C6 en C10 liggen in één vlak, maar kleine verbuigingen zijn mogelijk (zie Figuur 1).
Figuur 1
Daarnaast zitten er ook nog polaire en apolaire delen in het molecuul. De carbonylgroep op C3 is polair, met een beetje negatief geladen O-atoom en een beetje positief geladen C3-atoom. Ook de hydroxylgroep op C17 heeft een polair karakter met het O-atoom als negatief centrum.
Beide O-bevattende groepen kunnen daarnaast waterstofbruggen of H-bruggen vormen. De carbonylgroep is alleen een H-brug-acceptor, de hydroxylgroep is zowel een H-brug-acceptor en als een H-brug-donor. De bovenkant van het molecuul met de beide methylgroepen en de onderkant vormen de tamelijk grote apolaire stukken in het middendeel van testosteron. De interactie met de receptor vindt hier plaats met Van der Waals-krachten (zie Figuur 1).
De algemene aanduiding voor hormonen is ligand, en testosteron is dus de ligand voor de androgeenreceptor. Zo'n receptor is een groot eiwitmolecuul met een holte waarin de ligand past. Die holte heeft niet alleen een bepaalde pasvorm, maar er werken ook interacties om tot binding te komen, tussen de zijketens van de aminozuren aan de binnenkant van die receptorholte en het steroidhormoon. Over de aard van deze interacties gaat hoofdstuk 6.
In hoofdstuk 3 hebben we gezien dat een eiwit is opgebouwd uit aminozuren die samen een lange keten vormen. In de androgeenreceptor zijn 919 aminozuren aan elkaar gekoppeld, maar dit aantal kan per persoon een beetje varieren. Die 919 aminozuren vormen samen één heel groot molecuul met een molecuulgewicht van ongeveer 110000 D eenheden.
Door interacties tussen de peptide bindingen en de zijketens van de samenstellende aminozuren is die lange keten van aminozuren opgevouwen tot een losse kluwen. In die kluwen zijn verschillende gebieden die domeinen heten en elk hun eigen functie hebben.
Het molecuulgewicht van de ligand, testosteron, is 288 D eenheden. Het is duidelijk dat testosteron veel kleiner is dan zijn receptor. Er is dan ook maar een gedeelte van de hele receptor nodig om de holte te vormen waarin testosteron moet passen. Dit deel van het molecuul heet het ligandbindend domein.
In de androgeenreceptor is dit ligand-bindende domein opgebouwd uit ongeveer 256 aminozuren, die op de plaatsten 663-919 in de eiwit keten zitten.
De andere domeinen zijn nodig voor binding met begeleidende eiwitten, die helpen bij de binding van het receptor-ligand-complex met het stuk DNA, waarmee interactie moet plaatsvinden om de eiwitsynthese op te starten. In hoofdstuk 8 vertellen we meer over de rol van de verschillende domeinen in de androgeenreceptor.
Wetenschappers hebben een goed inzicht in de factoren die een rol spelen bij de binding tussen de ligand en de androgeenreceptor. Dit inzicht is belangrijk want de vorming van het ligand-receptor-complex is een essentiele stap in het hele proces. Als deze binding heeft plaatsgevonden, verandert het receptor-ligand-complex van vorm. Het complex maakt zich vrij van de eiwitten waarmee de lege receptor geassocieerd is. Het complex verplaatst zich daarna naar de celkern, waar het zijn functie moet uitoefenen.
Bij de binding tussen een receptor en zijn ligand spelen de zijstaarten van de aminozuren aan de binnenkant van de receptorholte een belangrijke rol. In hoofdstuk 3 hebben we gezien welke functionele groepen in deze zijketens zitten. Waterstofbruggen, dipool-dipool-interacties en apolaire interacties (Van der Waals-krachten) zorgen voor de binding tussen een ligand en zijn receptor.
De binding van een ligand en zijn receptor is uiteindelijk zwakker dan die van een gewone C-C binding. De sterkte van een permanente gewone C-C binding is 88 kcal/mol, terwijl de som van de zwakke interacties tussen een ligand en zijn receptor geschat wordt op 30-40 kcal/mol. Deze veel zwakkere binding is nodig omdat het ongewenst is dat de binding tussen een ligand en zijn receptor permanent is. Deze binding moet weer verbroken kunnen worden wanneer dat nodig is. De binding tussen ligand en receptor moet ook weer niet zo zwak zijn dat nauwelijks complexvorming optreedt.
In de androgeenreceptor spelen 18 aminozuren aan de binnenkant van de receptor holte een rol bij de binding van de ligand. Deze aminozuren zitten meestal niet naast elkaar in de eiwitketen, maar door de vouwing van de keten komen de aminozuur-zijketens vanuit verschillende delen van de eiwitketen samen in de holte, waar ze kunnen binden met de ligand.
Figuur 2 |
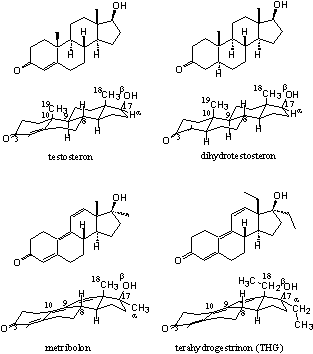
Voor een viertal combinaties van androgenen en het ligandbindende domein van de androgeenreceptor is bekend hoe het complex er uitziet, en welke factoren een rol spelen bij de binding. Dit is onderzocht met behulp van Rõntgen-diffractie (X-ray) van kristallen van de ligandbindende domein-ligand-complexen.
Het bepalen van zo’n X-ray is niet eenvoudig, want grote eiwitten kristalliseren niet gemakkelijk. Er is daarom nog geen X-ray beschikbaar van de volledige androgeenreceptor met daarin een ligand.
In 2006 is echter wel een X-ray bepaald van het complex van testosteron met het ligandbindende domein van de androgeenreceptor [1]. Er zijn ook X-rays beschikbaar van het ligandbindende domein van de androgeenreceptor en dihydrotestosteron (DHT) [2], metribolon [3][4] en tetrahydrogestrinon (THG) [1] (zie Figuur 2 voor de structuurformules). De laatste twee anabole steroïden hebben een andere interactie met de receptor dan testosteron en dihydrotestosteron.
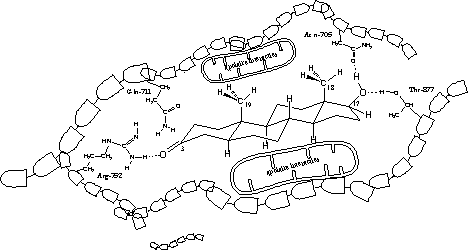
Uit de X-rays blijkt dat er altijd een H-brug aanwezig is tussen de zijketen van het aminozuur arginine op plaats 752 in de eiwitketen (Arg-752) en de carbonylgroep op C3. Het aminozuur is de H-brug-donor en het O-atoom van het steroidhormoon is H-brug acceptor (zie Figuur 3).
Volgens de X-rays van het testosteron- en het dihydrotestosteron-ligandbindende domein-complex speelt ook een H-brug een kleine rol, die je vindt tussen de zijketen van het aminozuur glutamine op plaats 711 in de eiwitketen (Gln-711) en het O-atoom van de carbonylgroep op C3.
In het THG- en het metribolon-ligand bindend domein complex is deze H-brug niet aanwezig. De plattere structuren van THG en metribolon zouden een verklaring kunnen zijn voor deze verschillen.
In alle gevallen spelen ook H-bruggen met één molecuul water, dat los in de holte zit in de buurt van de carbonylgroep, een rol (dit is niet aangegeven in Figuur 3).
De plattere structuren van THG en metribolon zorgen er tevens voor dat de waterstofbrug tussen de C3-carbonylgroep in deze moleculen en de zijketen van arginine een andere hoek krijgt, waardoor die waterstofbrug sterker wordt. De sterkste waterstofbruggen zijn lineair. De hoek tussen de bindingen is dan 180 graden.
Figuur 3
Klik op de figuur voor een grotere versie
Volgens de X-rays zitten er ook H-bruggen tussen de hydroxylgroep op C17 en de zijketen van asparagine op plaats 705 in de eiwitketen (Asn-705). De hydroxylgroep is de donor, het aminozuur de acceptor.
Dezelfde hydroxylgroep vormt een tweede H-brug met het O-atoom als acceptor, met de zijketen van het aminozuur threonine op plaats 877 in de eiwitketen (Thr-877) als donor.
De aminozuurzijketens in het midden van de receptorholte zijn apolair. Ze hebben apolaire Van der Waals-interacties met het apolaire middendeel van het steroidskelet.
In figuur 3 zie je deze interacties op moleculair niveau in een platte tekening. Op de tekening zie je dihydrotestosteron in de receptorholte van het ligandbindend domein van de androgeenreceptor. Het valt niet mee dat op een goede manier te tekenen. In werkelijkheid zijn de holte in de receptor en de vorm van dihydrotestosteron driedimensionaal.
De tekening maakt echter wel duidelijker welke factoren op moleculair niveau een rol spelen bij de binding van een ligand aan de androgeenreceptor. Belangrijk zijn de vorm van het hele molecuul, de carbonylgroep op C3 en de hydroxylgroep op C17, factoren die al vroeg als belangrijk zijn herkend.
De recente X-rays van het ligandbindend domein met testosteron, metribolon en het designersteroid tetrahydrogestrinon (THG) hebben echter aangetoond dat ook de apolaire interacties door Van der Waals-krachten een aanzienlijke bijdrage leveren aan de binding van de ligand [1].
De mogelijkheden voor interacties door Van der Waals-krachten nemen toe als het oppervlak van het ligandmolecuul toeneemt. De extra ethylgroepen aan C13 en C17 in THG vergroten het oppervlak van dit molecuul aanzienlijk. Dat is waarschijnlijk de verklaring voor de sterke binding van THG met de receptor.
Figuur 4 |
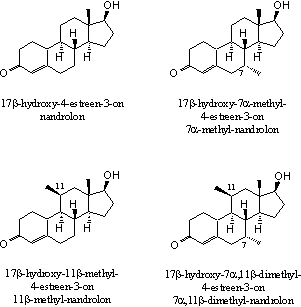
Aanvullend bewijs voor het effect van extra methyl- of ethylgroepen leveren de aanmerkelijk hogere bindingsaffiniteiten van nandrolonderivaten met extra methylgroepen op C7, C11 of op beide plaatsen (zie Figuur 4). De laatste verbinding, 17b-hydroxy-7a,11b-dimethyl-4-estren-3-on, heeft niet allen de sterkste binding met de receptor, maar heeft ook een verhoudingsgewijs krachtige anabole werking en een geringe androgene werking [5].
Chemici noemen anabole steroiden met meerdere methyl- of ethylgroepen ook wel stekelvarkensteroiden. Door het grotere oppervlak van deze moleculen zetten zij zich beter vast in de holte van de receptor. Het zou interessant zijn deze theorie een beetje verder uit te diepen door anabole steroïden te onderzoeken met aanvullende extra methylgroepen bijvoorbeeld op C14 en C15. Het invoeren van dergelijke groepen zal de synthese van deze moleculen echter moeilijker maken, met als gevolg dat zulke anabole steroïden prijzig zullen zijn.
De kennis die we krijgen door X-rays met elkaar te vergelijken is belangrijk voor het ontwerpen van nieuwe selectiefwerkende geneesmiddelen of nieuwe anabolen, met meer anabole en minder androgene effecten. Onderzoekers gebruiken de X-rays ook voor het ontwikkelen van volkomen nieuwe soorten liganden, met een structuur die niet meer op steroiden lijkt.
De vorm van nieuwe anabole steroiden moet lijken op de vorm van testosteron of dihydrotestosteron, anders passen ze niet in de receptorholte. De hydroxylgroep op C17 en de carbonylgroep op C3 zijn belangrijk. Vervanging van die groepen is alleen zinvol als de nieuwe groepen op die plaatsen evengoed of beter interactie hebben met de aminozuurzijketens. Misschien biedt ook het vermogen van glutamine - op plaats 711 in de keten - om H-bruggen te vormen mogelijkheden voor extra interacties. Die zouden bijvoorbeeld benut kunnen worden door het invoeren van polaire groepen op C1 en/of C2 van het steroid.
Los van alle speculatie merken we op dat de binding van een ligand aan zijn receptor tamelijk onvoorspelbaar is. Hoe gefundeerd je speculaties ook zijn, pas als je experimenten uitvoert weet je zeker hoe goed of slecht een anabool interacteert met zijn receptor. Soms hebben sterk op elkaar lijkende steroiden verschillende effecten; soms hebben steroiden met aanzienlijke verschillen in structuur toch vergelijkbare effecten.
Hoe subtiel alles op elkaar afgestemd moet zijn blijkt uit de relatieve bindingsaffiniteiten van testosteron, dihydrotestosteron en metribolon aan de androgeenreceptor. Deze zijn respectievelijk 100, 180 en 290. Uit deze getallen blijkt dat het synthetische metribolon de beste binding heeft met de receptor. Dit zou een gevolg kunnen zijn van de grotere flexibiliteit van dit molecuul, waardoor het zich beter aanpast aan de vorm van de receptorholte. Die grotere flexibiliteit is een gevolg van de dubbele bindingen in het molecuul, en de plaats van die bindingen.
Een goede binding van het ligand aan de receptor is bovendien niet het enige waar farmacologen op letten. Het lichaam moet het nieuwe anabool ook goed opnemen, snel naar de plaats van werking vervoeren en het anabool onderweg niet afbreken. Het ligand-receptor-complex moet in de cel bovendien meerdere processen op gang brengen. Een kleine verandering in de vorm van het complex kan ervoor zorgen dat er in de cel niets meer gebeurt.
Dit soort bijkomende interacties wordt meestal niet gemeten in proeven die bindingsaffiniteiten meten van liganden met het ligandbindende domein van de receptor. De voorspellende werking van die proeven is dan ook beperkt. De binding is belangrijk en een essentiele stap in het hele proces, maar het is niet de enige factor die bepalend is voor het uiteindelijke effect van een anabool steroid. In het volgende hoofdstuk gaan we daar verder op in.
[1] K. Pereira de Jesus-Tran, P-L. Cote, L. Cantin, J. Blanchet, F. Labrie en R. Breton, Protein Science (2006) 15, 987-999.
[2] J.S. Sack, K.F. Kish, C. Wang, R.M. Attar, S.E. Kiefer, Y. An, G.Y. Wu, J.E. Scheffler, M.E. Salvatie, S.R. Krystek Jr, R. Weinmann, en H.M. Einspahr, Proc. Nat. Acad. Sci. (2001) 98, 4904-4909.
[3] P.M. Matias, P. Donner, R. Coelho, M. Thomaz, C. Peixoto, S. Macedo, N. Otto, S. Joschko, P. Scholz, A. Wegg, S. Basler, M. Schafer, U. Egner en M.A. Carrondo, Journal of Biological Chemistry, (2000) 275, 26164-26171.
[4] B. He, R.T. Gample jr, A.J. Kole, A.T. Hnat, T.B. Stanley, G.An, E.L. Stewart, R.I. Kalman, J.T. Minges, and E.M. Wilson, Molecular Cell (2004) 16, 425-438.
[5] C.E. Cook and J.A. Kepler, Bioorganic and Medical Chemistry Letters (2005) 15, 1213-1216.
|
|