Het Anabolenboek
Willem Koert
Aede de Groot
Wageningen, 17/3/2007
11. Metabolisme van Testosteron, Dihydrotestosteron, Estron en Estradiol
Aede de Groot, Willem Koert
Het voornaamste door het lichaam zelf aangemaakte anabole steroid is testosteron. Dagelijks produceren de testes van de man ongeveer vier tot tien milligram testosteron. Daarnaast maakt de adrenalinecortex bij zowel mannen als vrouwen dagelijks een halve milligram testosteron per dag aan.
Enzymen zetten testosteron om in twee belangrijke andere steroidhormonen, dihydrotestosteron en estradiol. De omzetting in dihydrotestosteron vindt plaats in weefsels zoals de huid en de prostaat, maar niet in de spieren. De vorming van estradiol vindt bij mannen vooral plaats in vetweefsels en, voor een kleiner deel, in de testes. Bij vrouwen ontstaat estradiol vooral in de ovaria.
Testosteron en dihydrotestosteron de natuurlijke liganden voor de androgeenreceptor. Ze zorgen samen voor de ontwikkeling van de typisch mannelijke geslachtskenmerken, maar hun functie is verschillend. In de puberteit induceert testosteron de vergroting van de penis en de testes, de aanmaak van sperma, de toename van spiermassa en mineralisering van botten. Dit zijn de anabole effecten.
In weefsels zoals de huid en de prostaat wordt testosteron omgezet in dihydrotestosteron. Dihydrotestosteron zorgt voor een toename van de lichaamsbeharing, baardgroei, acne en in een later stadium voor kaalheid en vergroting van de prostaat. Dit zijn de androgene effecten.
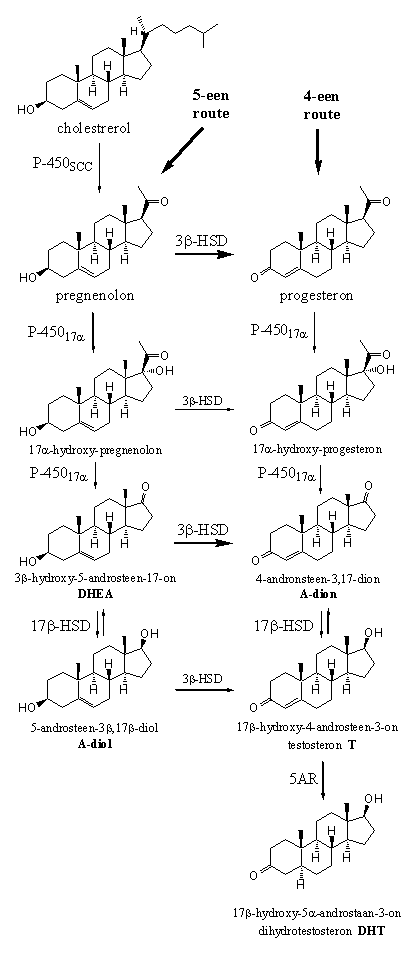
Biochemici hebben veel onderzoek gedaan naar de biosynthese van steroidhormonen, vooal omdat de toepassing van deze hormonen als geneesmiddel veelbelovend leek. De biosynthese van de mannelijke en vrouwelijke geslachtshormonen testosteron, dihydrotestosteron, estron en estradiol is grotendeels bekend en weergegeven in de schema’s 1 en 2. Er zijn goede overzichten verschenen in de literatuur [1][2].
De biosynthese van de geslachtshormonen begint bij cholesterol met de oxidatie van de zijketen van dit molecuul met behulp van het enzym cytochroom P450scc. Dit cytochroom oxideert de zijketen van cholesterol op C20 en C22 door de invoering van twee hydroxylgroepen. Hetzelfde enzym breekt daarna de keten tussen deze twee atomen. Zo ontstaat pregnenolon.
Het vervolg van de biosynthese van testosteron verloopt via twee routes. Cytochroom P45017a kan eerst de oxidatie van pregnenolon katalyseren tot 17a-hydroxy-pregnenolon. Dit gebeurt in de 5-een route. Die heet zo omdat in alle tussenproducten van deze route een D5-dubbele binding zit.
Het enzym 3b-HSD kan pregnenolon ook eerst omzetten in progesteron door oxidatie van de b-hydroxylgroep op C3 en verschuiving van de dubbele binding van C5-C6 naar C4-C5 (zie verderop). Dit gebeurt in de 4-een route. Die heet zo omdat in alle tussenproducten van deze route een D4-dubbele binding zit.
Het enzym cytochroom P45017a kan zowel pregnenolon als progesteron omzetten. Het kan in beide substraten een hydroxylgroep invoeren op de 17a-positie, zoals de naam van het enzym al aangeeft. Hetzelfde enzym katalyseert vervolgens ook de verbreking van de C17-C20-binding waardoor de hele zijketen van het steroidskelet verdwijnt en alleen een carbonylgroep overblijft. Dit leidt in de 4-een route tot de vorming van 4-androsteen-3,17-dion (A-dion) en in de 5-een route tot van 3b-hydroxy-5-androsteen-17-on (DHEA). De afkorting DHEA komt van de ouderwetse naam dehydroepiandrosteron voor deze verbinding. We zullen hier deze afkorting voor dit steroid gebruiken omdat hij zozeer is ingeburgerd dat misverstanden niet meer zullen optreden. DHEA heeft zelf een zeer zwakke, praktisch te verwaarlozen anabole werking.
Schema 1
Het enzym 3b-hydroxy-steroid dehydrogenase/D5-D4-isomerase, of 3b-HSD, katalyseert de oxidatie van de 3b-hydroxylgroep tot een carbonylgroep en de verschuiving van de dubbele binding van de D5- naar de D4-positie. 3b-HSD oxideert eerst de hydroxylgroep aan C3 door de H-atomen aan het O-atoom en aan C3 weg te halen. Hetzelfde enzym katalyseert daarna ook de isomerisatie van de dubbele binding van plaats 5 naar plaats 4.
De oxidatie treedt eerst op. Daarna volgt pas de isomerisatie. De reactie gaat maar één kant op. In principe kan dit enzym alle substraten in de linker kolom in Schema 1 omzetten, maar het doet dat vooral met pregnenolon en met DHEA. Dat is aangegeven door een dikkere reactiepijl.
Voor de omzetting van A-dion in testosteron is nu alleen nog de reductie nodig van de carbonylgroep op C17 naar een hydroxylgroep. Deze reactie wordt weer gekatalyseerd door een dehydrogenase-enzym. Dat is dit keer het 17b-hydroxy-steroid dehydrogenase of 17b-hydroxysteroid oxidoreductase of kortweg 17b-HSD. Dit enzym voegt op C17 twee H-atomen toe aan de carbonylgroep, eentje op het O-atoom en eentje aan de onderkant op C17, waardoor de hydroxylgroep aan de bovenkant, de b-kant, terecht komt.
Testosteron wordt in een aantal weefsels in het lichaam, zoals de huid en de prostaat, verder omgezet in 5a-dihydrotestosteron (DHT). De volledige naam van het enzym dat deze omzetting katalyseert is 3-oxo-a-steroid-D4-dehydrogenase, of kortweg 5AR. De aanduiding 5a-steroid-D4 geeft aan dat de H-atomen aan de onderkant van het molecuul aangebracht worden aan de C4=C5-dubbele binding. Ook deze omzetting gaat maar één kant op.
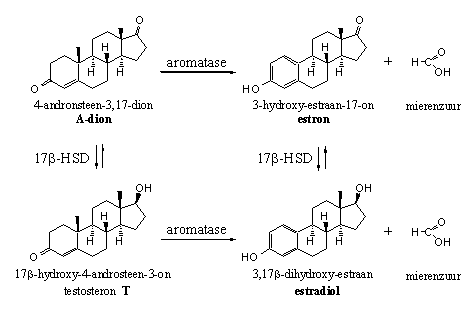
De oestrogenen estron en estradiol zijn samen met progesteron de belangrijkste vrouwelijke geslachtshormonen. De oestrogenen zijn verantwoordelijk voor de karakteristieke vrouwelijke geslachtskenmerken en zorgen voor de groei en ontwikkeling van de vagina, de uterus, de eileiders, de ontwikkeling van de borsten en de toename van vetweefsel. Samen met progesteron regelen ze de menstruatiecyclus. De activiteit van estradiol is vele malen groter dan die van estron. Het enzym 17b-HSD kan beide stoffen in elkaar omzetten.
Schema 2
De biosynthese van estron en estradiol gaat uit van A-dion, en kan verlopen via twee routes (zie Schema 2). 17b-HSD kan eerst de C17-carbonylgroep in A-dion reduceren tot een 17b-hydroxylgroep onder vorming van testosteron. Daarna volgt de oxidatie en afsplitsing van de C19-methylgroep en aromatisering van ring A.
De oxidatie van de C19-methylgroep en de aromatisering kan ook als eerste optreden in A-dion onder vorming van estron. Daarna leidt reductie van de carbonylgroep op C17 tot estradiol.
Een complex van cytochroom P450-enzymen met de code P450aromatase of kortweg aromatase katalyseert de oxidatie van de C19-methylgroep. Het enzymcomplex oxideert de C19-methylgroep eerst tot een hydroxylgroep en daarna tot een carbonylgroep (een aldehyde). Als laatste stap volgt de afsplitsing van mierenzuur samen met een H-atoom van C1, onder gelijktijdige aromatisering van ring A. De splitsing van de C10-C19 binding is een belangrijke stap in deze aromatiseringsreactie. Ook deze omzetting gaat maar één kant op.
In de schema’s 1 en 2 hebben we gezien dat het lichaam testosteron op twee manieren verder kan omzetten. Chemici zeggen dan dat het metabolisme van testosteron op twee manieren kan verlopen; op een reductieve manier tot dihydrotestosteron en op een oxidatieve manier tot estradiol. De reductie van testosteron tot dihydrotestosteron vindt plaats in doelweefsels zoals de prostaat, de huid en in de lever. Slechts een zeer klein deel (0.2 procent) van de testosteron bij mannen oxideert tot estradiol. Dit proces treedt vooral op in vetweefsel en voor ongeveer twintig procent in de testes. Bij vrouwen vindt de biosynthese van estradiol vooral plaats in de ovaria.
Metabolisme van testosteron en dihydrotestosteron vindt voor negentig procent plaats in de lever. Reductases en dehydrogenases katalyseren daar reacties met de D4-dubbele binding, de carbonylgroep op C3 en de hydroxylgroep op C17. Daarna reageren de hydroxylgroepen met glucuronzuur of sulfaat en volgt uitscheiding van het steroid [3] [4].
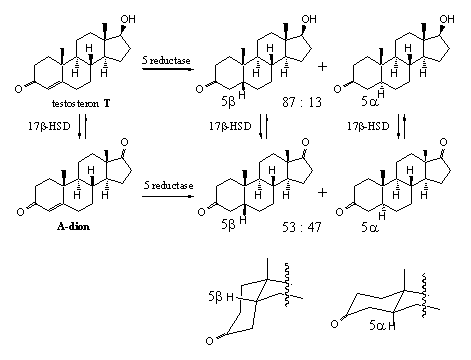
De reductie van de D4-dubbele binding gaat maar één kant op en kan op een 5a en/of een 5b-manier plaatsvinden (zie Schema 3). In de prostaat is vooral het enzym 5a-reductase actief. Dat zet testosteron om in 5a-dihydrotestosteron. In de lever is de verhouding tussen 5a- en 5b-reductie, door de daar aanwezige 5a- en 5b-reductases, afhankelijk van de structuur van het steroid.
Een voorbeeld is het verschil in de verhouding van de 5a- en 5b-reductieproducten bij testosteron en A-dion. Testosteron heeft een C17-b-hydroxylgroep en A-dion heeft een C17-carbonylgroep. Bij testosteron is de verhouding 5b : 5a reductieproducten 87 : 13. Bij A-dion is die verhouding 53 : 47 (zie schema 3) [3].
Bij andere steroiden is die verhouding soms weer heel anders. Er is meestal wel een zekere voorkeur voor 5b-reductie.
Schema 3
Na reductie van de D4-dubbele binding treedt meestal ook snel reductie van de C3-carbonylgroep op. In de 5a-steroiden zie je bij voorkeur reductie tot de 3b-hydroxylverbinding. In de 5b-steroiden vindt alleen reductie tot de 5a-hydroxylverbinding plaats.
De C3- en C17-dehydrogenases katalyseren reversibele reacties, dus reacties die beide kanten op kunnen. De 3-hydrogenases kunnen de 3a- of 3b-hydroxylgroepen weer oxideren tot een C3-carbonylgroep. De C17-dehydrogenases oxideren de hydroxylgroep op C17- tot een C17-carbonylgroep. Ze kunnen die C17-carbonylgroep op zijn beurt weer reduceren tot een 17b- of tot een 17a-hydroxylgroep.
Uiteindelijk bindt een glucuronosyltransferase (UGT) een molecuul glucuronzuur aan de hydroxylgroepen op C3 of C17 en soms aan allebei [5]. Sulfatases zetten maximaal tien procent van de hydroxylgroepen om in sulfaatgroepen. Beide groepen verhogen de polariteit van het hele molecuul en daarmee zijn oplosbaarheid in water. Het lichaam scheidt de gevormde glucuroniden of sulfaten daarna uit via de nieren in de urine.
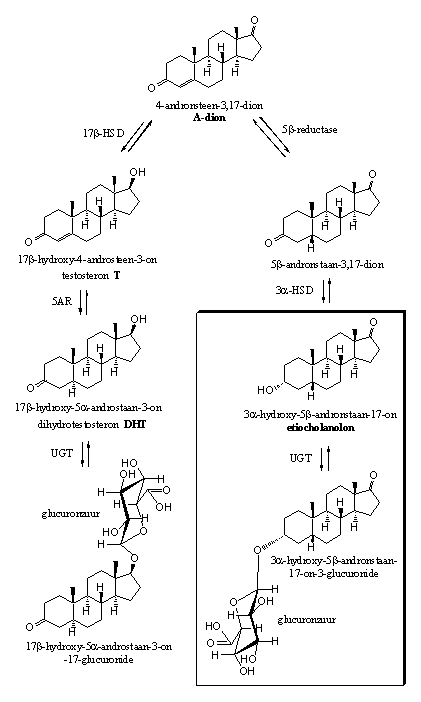
In schema’s 4 en 5 zijn een aantal van de mogelijke metabole reacties van testosteron en dihydrotestosteron weergegeven. De belangrijkste metabole producten die uitgescheiden worden zijn 3a-hydroxy-5b-andronstaan-17-on (etiocholanolon) en 3a-hydroxy-5a-androstaan-17-on (androsteron). Deze stoffen zijn omkaderd in de schema’s. Het lichaam scheidt ze vooral uit als glucuronide.
Schema 4
De andere mogelijke metabolieten zitten slechts in geringe concentraties in de urine. Dit zijn 5a- of 5b-gereduceerde steroiden met 3a- of 3b-hydroxylgroepen, 17-carbonylgroepen en 17a- of 17b-hydroxylgroepen. Deze stoffen zijn maar gedeeltelijk in de schema’s 4 en 5 opgenomen.
Omzettingen van testosteron treden bij orale inname snel op. Ongeveer negentig procent is al omgezet voordat het hormoon de bloedstroom bereikt. Daarna neemt de hoeveelheid ingenomen hormoon binnen elk half uur steeds met de helft af. Wetenschappers zeggen dan dat de halfwaardetijd van testosteron in het bloed minder is dan dertig minuten. Het is dus geen wonder dat onderzoekers uitvoerig hebben gezocht naar andere toedieningsvormen.
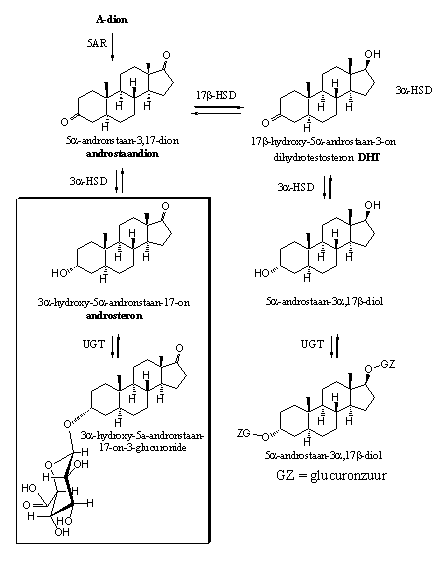
Schema 5
Wat testosteron betreft zijn die oplossingen vooral gezocht in het gebruik van esters. Esterases zetten de esters langzaam om in het vrije testosteron. Een andere oplossing is toediening via de huid door middel van pleisters of zalven die langzaam testosteron afgeven, direct aan het bloed.
Als het synthetische testosteron eenmaal in vrije vorm in het lichaam aanwezig is, verwijdert het metabolisme het natuurlijk weer op dezelfde snelle manier. Er is dus een constante aanvoer nodig om het niveau op peil te houden.
Chemici kunnen ook veranderingen aanbrengen in de structuur van testosteron of andere anabole steroiden, waardoor die minder snel - of soms helemaal geen - metabole omzettingen meer ondergaan. Deze mogelijkheden zijn uitvoerig onderzocht, en waren vooral gericht op de creatie van oraal beschikbare anabole steroiden. Die anabolen moeten bij voorkeur ook nog actiever zijn dan testosteron en naar verhouding meer anabole en minder androgene effecten hebben.
[1] Brown, G.D. Natural Product Reports (1998) 661-665.
[2] Brueggemeier R.W. Encyclopedia of Molecular Cell Biology and Molecular Medicine Vol 13, 1-69.
[3] Schanzer W. Clinical Chemistry (1996) 42, 1101-1020.
[4] Van Eenoo P., Delbeeke F.T. J. of Steroid Biochem. and Mol. Biochem. (2006) 101, 161-178.
[5] Belanger A., Pelletier G., Labrie F., Barbier O. en Chouinard S. Trends in Endocrin. and Metab. (2003) 14, 473-479.
|
|