Het Anabolenboek
Willem Koert
Aede de Groot
Wageningen, 23/3/2007
12. Preventie van Metabole Omzettingen van Anabole Steroiden
Aede de Groot, Willem Koert
In Hoofdstuk 10 hebben we gekeken naar de enzymatische reacties die bij metabole omzettingen van anabole steroïden een rol spelen. In Hoofdstuk 11 hebben we gezien hoe enzymen helpen bij het metabolisme van testosteron en de andere steroiden. Schema 1 vat de belangrijkste omzettingen en daarbij betrokken enzymen samen.
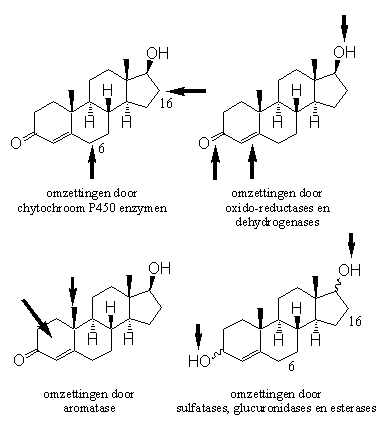
Schema 1
In dit hoofdstuk behandelen we in algemene zin hoe we ongewenste enzymatische omzettingen van anabole steroiden in het lichaam kunnen voorkomen. Veel synthetische anabolen lijken nog genoeg op de van nature in ons lichaam voorkomende steroiden om ook synthetische anabolen om te zetten. Chemici kunnen hier echter iets aan doen door de structuur van die synthetische anabolen wat te veranderen. Hoe precies, dat vertellen we in de hoofdstukken 13 en 14.
We moeten eerst weer even terug naar enzymen en receptoren en hun verschil in behandeling van substraat en ligand. Een enzym bindt een substraat om daarin een verandering aan te brengen, het substraat moet reageren tot een andere verbinding. Een receptor bindt met een ligand om samen een verandering van vorm te ondergaan zonder dat daarbij een reactie moet plaatsvinden. Het ligand verlaat de receptor weer in onveranderde toestand.
Anabole steroiden moeten bij voorkeur lang werken. Snelle metabole omzettingen door enzymen zijn daarom ongewenst. Bij het ontwerpen van nieuwe anabole steroiden moeten we er dus voor zorgen dat de interactie met de androgeen receptor nog wel plaatsvindt maar dat omzettingen door enzymen niet meer optreden. Dit betekent dat de veranderingen in de structuur van nieuwe anabolen niet al te groot mogen zijn omdat de anabolen nog steeds in de holte van de receptor moeten passen.
We kunnen dit in principe op twee manieren aanpakken.
- We kunnen de structuur van het anabool zo veranderen dat een omzetting om chemische redenen niet meer mogelijk is.
- We kunnen chemische omzettingen verhinderen of vertragen door sterische hinder.
Een mooie illustratie van beide punten is het aanbrengen van een 17a-methylgroep in anabolen. De 17a-methylgroep zorgt er voor dat enzymen de gewenste 17b-hydroxylgroep niet meer kunnen oxideren tot een ongewenste 17-carbonylgroep. Bovendien bemoeilijkt de methylgroep de omzetting van de hydroxylgroep in een glucuronide of sulfaat.
Een methylgroep is klein genoeg om een anabool met een extra methylgroep nog goed in de receptorholte te laten passen. Een methylgroep is ook klein genoeg om een anabool nog in de holte van het enzym te laten passen. Toch kan oxidatie van de 17-hydroxylgroep niet meer plaatsvinden om een elementaire chemische reden. Door het vervangen van het 17a-H-atoom door een 17a-methylgroep kan er geen dehydrogenering meer plaatsvinden. Er zit op C17 nu domweg geen H-atoom meer en het enzym kan dat er dus ook niet meer afhalen.
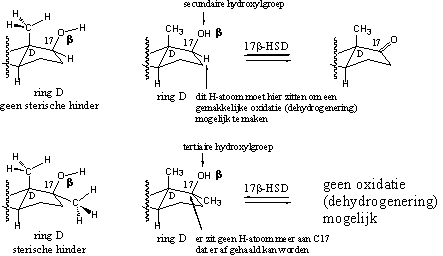
Schema 2
Dit kunnen we ook op een chemische manier uitleggen. In testosteron zit op C17 een secundaire hydroxylgroep. Dehydrogenases kunnen die op een normale manier tot een carbonylgroep oxideren. De enzymen verwijderen een H-atoom van C17, het C-atoom waaraan de hydroxylgroep vastzit, en een H-atoom van het O-atoom, onder vorming van een carbonylgroep. Het dehydrogenase-enzym moet beide H-atomen tegelijkertijd verwijderen. Als op C17 een a-methylgroep zit, zoals in methyltestosteron, dan verandert de secundaire hydroxylgroep in een tertiaire hydroxylgroep. Dehydrogenases kunnen geen tertiaire hydroxylgroepen oxideren. Er zit nu geen H-atoom meer aan C17 dat er af kan.
Oxidatie van een tertiaire hydroxylgroep kan alleen plaatsvinden na verbreking van een C-C-binding. Dat is een gecompliceerd proces, dat alleen onder geforceerde omstandigheden optreedt. Een dehydrogenase krijgt dat niet voor elkaar.
In Schema 2 leggen we dit nog een keer uit, maar nu aan de hand van eenvoudige alcoholen (hydroxylverbindingen). Er bestaan drie soorten alcoholen: primaire, secundaire en tertiaire.
Die drie soorten zijn gedefinieerd door het aantal bindingen naar andere C-atomen van het C-atoom waaraan de hydroxylgroep zit. Primaire hebben één, secundaire twee en tertiaire drie bindingen naar andere C-atomen (zie Schema 3).
Bij een oxidatie (dehydrogenering) halen enzymen H-atomen weg van het O-atoom en van het C-atoom waaraan de hydroxylgroep zit. In het schema duiden we die H-atomen aan met vette letters. Enzymen moeten deze twee H-atomen tegelijkertijd uit het molecuul verwijderen. Ze kunnen zo de primaire alcohol ethanol eenvoudig dehydrogeneren tot de carbonylverbinding aceetaldehyde. Dit gebeurt gedeeltelijk al in de maag, wanneer je alcoholische dranken drinkt. De secundaire alcohol kan op dezelfde manier omgezet worden in aceton. Bij de tertiaire alcohol zit er geen H-atoom meer aan het C-atoom waaraan de hydroxylgroep zit en dan valt er dus ook niks meer te dehydrogeneren. Een dehydrogenase kan een tertiaire alcohol niet oxideren.
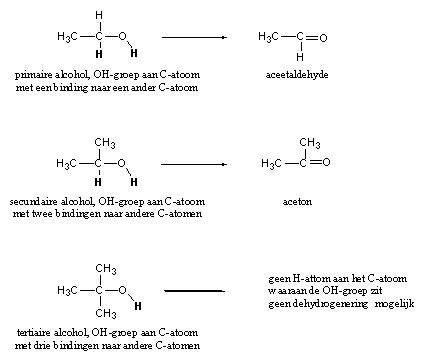
Schema 3
Het tweede algemene aspect van chemische reacties dat aan de orde moet komen is sterische hinder. Sterische hinder is een puur ruimtelijk effect. Als een reagens niet meer bij de groep kan komen waarmee het moet reageren dan gebeurt er dus niets. We hebben steeds de nadruk gelegd op het feit dat moleculen een vorm hebben en ruimte innemen. Afzonderlijke groepen binnen moleculen doen dat ook. Ze kunnen zo delen van het molecuul in hun buurt afschermen en ontoegankelijk maken voor reacties.
We kunnen de invloed van sterische hinder opnieuw laten zien met anabolen met een 17a-methylgroep als voorbeeld. Daartoe zijn in Schema 2 in de structuurformules aan de linkerkant de methylgroepen aan C13 en C17 helemaal uitgetekend. In de uitgetekend vorm kun je zien dat een methylgroep meer ruimte inneemt dan een H-atoom. Dit heeft tot gevolg dat de hydroxylgroep in de 17a-methyl verbinding linksonder lastiger toegankelijk is voor allerlei reacties dan in de 17a-H verbinding linksboven. In de 17a-methyl verbinding kunnen de katalytische groepen van het enzym minder goed bij de 17 hydroxylgroep komen door de sterische hinder van de C13 en C17 methylgroepen. In de 17a-H verbinding is nadering vanaf de onderkant van het molecuul nog goed mogelijk.
De toegenomen sterische hinder heeft tot gevolg dat enzymen de hydroxylgroep in de 17a-methyl verbinding minder gemakkelijk omzetten in een glucuronaat of sulfaat. De 17a-methyl anabolen verlaten daardoor het lichaam minder snel, waardoor ze hun functie langer kunnen uitoefenen.
Verwar de omzetting van de 17b-hydroxylgroep in een glucuronaat of sulfaat niet met de oxidatie van de 17b-hydroxylgroep tot een carbonylgroep. De omzetting van de 17b-hydroxylgroep in een glucuronaat of sulfaat is een reactie aan het O-atoom van de hydroxylgroep. Het H-atoom of de methylgroep aan C17 is daarbij niet betrokken. Een reactie op het O-atoom is door de sterische hinder van de extra methylgroep wel lastiger maar niet onmogelijk.
De 17a-methylgroep heeft dus een dubbele functie. Hij voorkomt om chemische redenen de oxidatie van de 17b-hydroxylgroep en hij vertraagt om sterische redenen de omzetting van deze groep in een glucuronaat of een sulfaat. Het sterische effect van de extra methylgroep is aan de andere kant zo klein dat nog steeds een goede interactie met de receptor mogelijk is.
De interactie van de receptor met de 17a-methyl-anabolen zal waarschijnlijk wel iets anders zijn dan als daar alleen maar een H-atoom zit, maar in grote lijnen zal het bindingsproces op identieke manier verlopen. Het wordt natuurlijk nog mooier als door modificaties in het steroid enzymen het niet meer kunnen omzetten, en tegelijkertijd de ligand-receptor interactie verbetert. Dat is lastig maar niet onmogelijk. Voorbeelden vind je vooral bij anabolen met een 17a-methyl- of ethylgroep.
In Hoofdstuk 7 is beschreven dat extra methylgroepen een betere binding tussen anabool en receptor kunnen geven omdat extra groepen het oppervlak van het molecuul vergroten. Dat is gunstig voor een betere interactie door Van der Waals-krachten. Dat geeft op zijn beurt een betere binding tussen ligand en receptor. Deze verbeterde binding is meestal gunstig voor het anabole effect van de stof.
Anabole steroïden met een 17a-methylgroep hebben niet alleen een verbeterd anabool effect, maar zijn ook riskant voor de lever. We hebben in de literatuur geen aanwijzingen gevonden over de oorzaak van dit effect. Een voor de hand liggende speculatie is dat 17a-methylanabolen langer in het lichaam circuleren en dus ook meer tijd krijgen om kwaad te doen. Een andere speculatie is dat 17a-methylanabolen, omdat ze niet op de gewone manier metaboliseren, andere omzettingen ondergaan. Daarbij ontstaan misschien levertoxische producten.
|
|