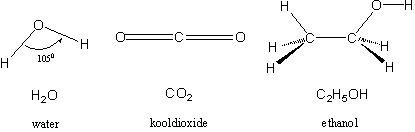09.11.2011 | ||||
2. Vormen van eenvoudige koolstofverbindingen
In het vorige hoofdstuk schreven we hoe organisch-chemici, biochemici en farmacologen samen zoeken naar hormonen waarmee ze biologische processen kunnen bijsturen. Een belangrijke stap in die zoektocht is het vinden van het aangrijpingspunt, de receptor, van die stof. Voor anabole steroïden is dat aangrijpingpunt de androgeenreceptor.
Een receptor is een groot eiwitmolecuul, waarin een holte aanwezig is waarin een verbinding moet passen van de werkzame verbinding. Zo'n verbinding heet een 'ligand'. Past het ligand in de receptor, dan ontstaat een ligand-receptor-complex, waardoor het receptoreiwit van vorm verandert en actief wordt. Het passen van de ligand in de receptor is het gevolg van een interactie op moleculair niveau. We zullen nagaan welke factoren daarbij een rol spelen.
Daarvoor is enige chemische basiskennis nodig. We kijken daarom eerst naar de namen en vormen van enkele eenvoudig koolstofverbindingen.
Elke organische stof bestaat uit een groot aantal moleculen. Die moleculen zijn de kleinst mogelijke bestanddelen van een stof. Ze zijn zo klein dat ze ook met de krachtigste instrumenten niet afzonderlijk zichtbaar zijn. Toch hebben die moleculen een vorm. Die vorm bepaalt of het molecuul past in de holte van een receptor.
De afzonderlijke moleculen van een stof zijn op hun beurt opgebouwd uit atomen. De brutoformule van een stof geeft aan uit hoeveel van welke atomen hij bestaat. Voor testosteron is die brutoformule C19H28O2, wat betekent dat testosteron bestaat uit 19 koolstofatomen (C), 28 waterstofatomen (H) en 2 zuurstofatomen (O). De atomen van de elementen C, H en O hebben elk hun eigen grootte en bindingsmogelijkheden. Samen bepalen die de grootte en vorm van het testosteronmolecuul.
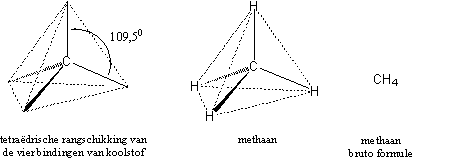
In het eerste hoofdstuk vertelden we al dat koolstof het belangrijkste element is in organische stoffen en dat alle natuurproducten bestaan uit verbindingen van dit element. Afzonderlijke atomen van koolstof hebben vier mogelijkheden om te binden met andere atomen, en in alle koolstofverbindingen worden deze vier mogelijkheden altijd allemaal gebruikt. Die vier bindingsmogelijkheden, kortweg de vier bindingen van koolstof, zijn gericht naar de hoekpunten van een tetraëder en maken dus een onderlinge hoek van 109,5 graden met elkaar (zie Figuur 1).
Het tweede element in testosteron is waterstof (H). Waterstof is het eenvoudigste element dat we kennen, en heeft maar één mogelijkheid om met andere atomen te binden. Eén koolstofatoom (C) kan met zijn vier bindingen dus vier waterstofatomen (H) binden en vormt dan het molecuul CH4. Dat molecuul heet methaan en het is het voornaamste bestanddeel van aardgas. Omdat de bindingen van het C-atoom gericht zijn naar de hoekpunten van een tetraëder zitten de H-atomen in methaan ook op de hoekpunten van die tetraëder. Daarmee is de vorm van het methaanmolecuul bepaald (zie Figuur 1).
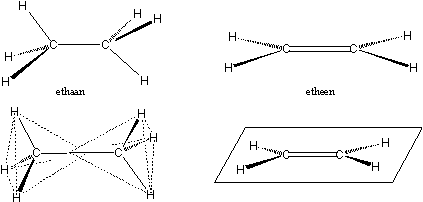
C-atomen kunnen ook prima met elkaar binden, en op die manier zet de natuur oneindig veel moleculen met koolstof in elkaar. Eenvoudige voorbeelden zijn de moleculen ethaan en etheen. De twee C-atomen in ethaan gebruiken elk één binding om elkaar vast te houden, de andere drie bindingen aan elk C-atoom zijn bezet met H-atomen (zie Figuur 2).
In etheen zijn de beide C-atomen met twee bindingen aan elkaar gebonden. Dit heet 'dubbele binding'. De overige twee plaatsen aan elk C-atoom zijn door H-atomen bezet. Etheen is een belangrijk plantenhormoon, het zorgt voor de rijping van fruit en de veroudering van de plant.
Ethaan en etheen verschillen maar twee H-atomen van elkaar. Dat kleine verschil heeft echter grote gevolgen voor de chemische eigenschappen en vorm van de twee verbindogen. Ethaan heeft zo ongeveer de vorm van een zandloper. Het bijzondere van een dubbele binding is, dat alle atomen die aan en naast een dubbele binding zitten, in één vlak liggen. Etheen is daarom een vlak molecuul. (zie Figuur 2).
Als dit structuurelement van de dubbele binding onderdeel is van een groter molecuul, dan is dat molecuul ook vlak rond die dubbele binding. Zo’n structuurelement heeft dus invloed op de vorm van dat grotere molecuul. In testosteron zit bijvoorbeeld één dubbele binding, een synthetisch anabool steroid als trenbolon heeft er drie. De dubbele bindingen maken van trenbolon een platter molecuul dan testosteron.
Het derde element in testosteron is zuurstof (O). Zuurstof heeft twee mogelijkheden om met andere atomen te binden. Een zuurstof-atoom kan dus twee waterstof-atomen (H) binden. Dan heb je het molecuul H2O. Beter bekend als water.
De beide H-atomen en het O-atoom liggen in één vlak. De bindingen in het watermolecuul vormen een hoek met elkaar van 105 graden.
Eén C-atoom kan met zijn vier bindingsmogelijkheden twee O-atomen met elk twee bindingen vasthouden. Dan krijgen we het molecuul CO2, beter bekend als kooldioxide. De beide dubbele bindingen in CO2 liggen in elkaars verlengde, en kooldioxide is daarom een lineair molecuul.
Een bekend molecuul waarin zowel C-C, C-O, C-H als O-H bindingen voorkomen is ethanol of alcohol. Ethanol ontstaat als je één van de H-atomen in water vervangt door een ethylgroep, een groep van twee C-atomen die is afgeleid van ethaan.
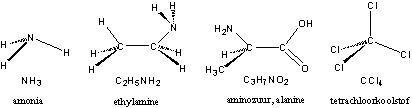
Er zijn nog vier andere atomen die in anabole steroïden kunnen voorkomen. Dat zijn stikstof (N) en de halogeenatomen fluor (F), chloor (Cl) en soms broom (Br). Er zit een F-atoom in het anabole steroid fluoxymesteron, een Cl-atoom in Oral-Turinabol en een Br-atoom in het steroid in Hyperdrol. Er zitten tenslotte twee N-atomen in stanozolol.
Het N-atoom heeft drie bindingsmogelijkheden. De eenvoudigste stikstofverbinding is ammonia (NH3) (zie Figuur 4). Als we, net als bij water en ethanol, één van de H-atomen in ammonia vervangen door een ethylgroep, dan krijgen we ethylamine. Stikstof komt voor in alle aminozuren, de bouwstenen voor eiwitten. Een voorbeeld is het aminozuur alanine. Meer over eiwitten en aminozuren vertellen we in het volgende hoofdstuk.
De halogeen atomen F, Cl en Br hebben alledrie maar één bindingsmogelijkheid voor andere atomen. Een C-atoom kan dus 4 Cl-atomen binden. Dat gebeurt bijvoorbeeld in tetrachloorkoolstof (CCl4). Een eenvoudige chloorbevattende stof is HCl, ofwel zoutzuur.
Terug: Verder:
|